
Assuntos de química que mais caem no Enem estão entre as principais dúvidas de quem estuda para a prova de...
O conceito de osmose é fundamental para a Biologia no Enem e vestibulares, pois se conecta com a fisiologia celular, homeostase e aplicações tecnológicas. O artigo detalha a definição de osmose, suas consequências práticas em células animais e vegetais, além de exemplos cotidianos e questões de provas. A osmose é a difusão do solvente, geralmente a água, através de uma membrana semipermeável, movendo-se da área menos concentrada em soluto para a mais concentrada, sem gasto de energia. O texto explica os estados isotônico, hipertônico e hipotônico, que determinam o fluxo de água e afetam o volume e a pressão celular. Também são abordados conceitos como pressão osmótica e osmose reversa e suas implicações no cotidiano e em processos biológicos naturais.
Dominar o conceito de osmose é uma das chaves para se destacar na prova de Biologia do Enem e dos vestibulares.
Isso porque a osmose não é um tópico isolado, ela é um processo fundamental que conecta a fisiologia celular, a homeostase dos organismos e até aplicações tecnológicas, sendo frequentemente o núcleo de questões interdisciplinares mais complexas.
Portanto, este artigo foi estruturado com o objetivo de fornecer a você, estudante, uma compreensão clara, aplicável e útil sobre osmose.
Você entenderá não apenas a definição, mas como e por que ela ocorre, suas consequências práticas em células animais e vegetais, e sua relação com conceitos como pressão osmótica e osmose reversa.
Mais do que teoria, apresentaremos exemplos concretos do cotidiano e, principalmente, de como esse tema é cobrado nas provas com exemplos de questões.
Assim, ao final desta leitura, você estará preparado para identificar, analisar e resolver com segurança questões que envolvam o movimento de água através de membranas. Vamos, pois, direto ao ponto.
Em sua essência, a osmose é um tipo específico de difusão, que é o movimento de moléculas de um ponto de concentração maior para um menor, visando igualar as concentrações de um meio.
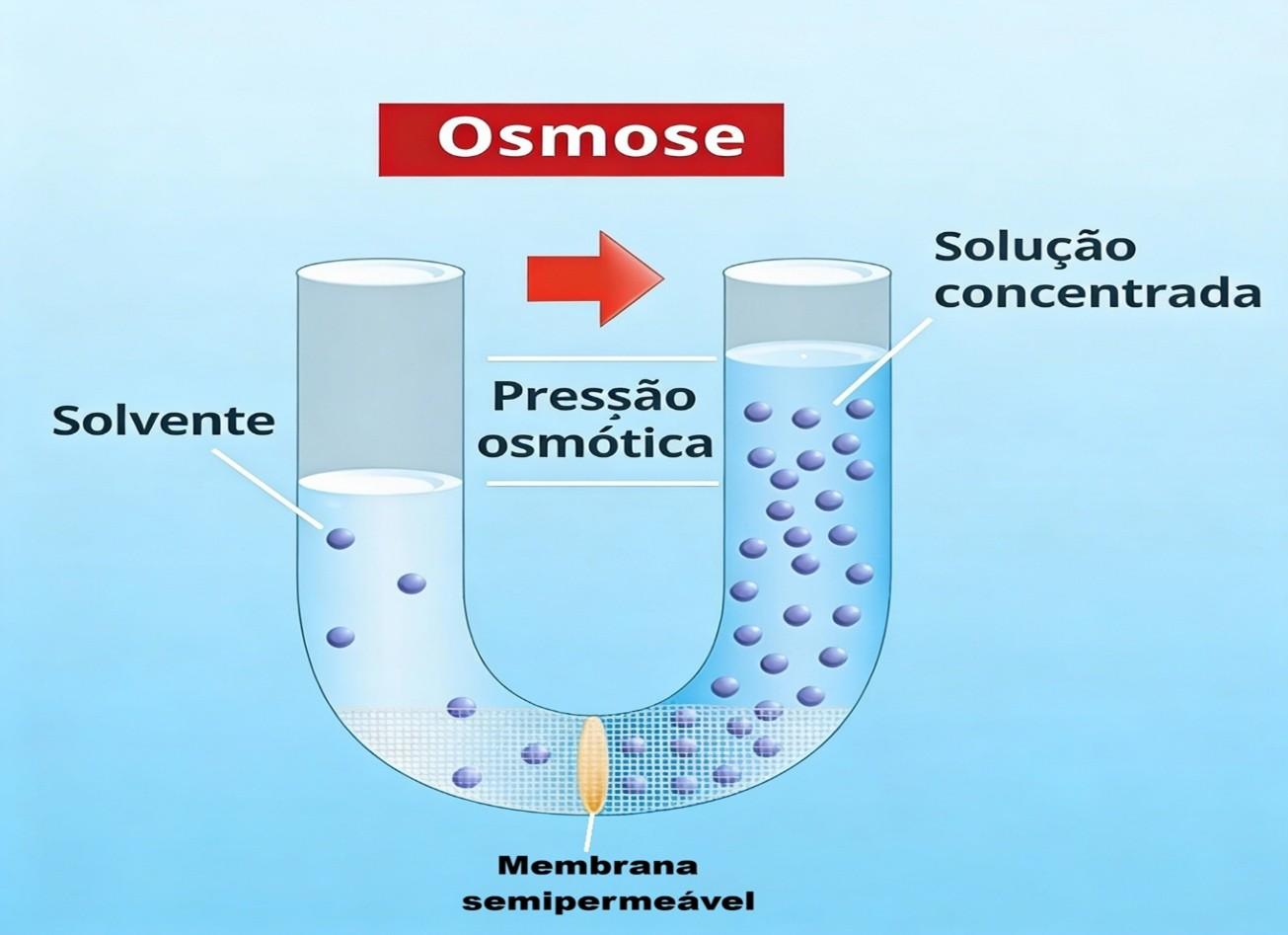
Por conseguinte, enquanto a difusão simples envolve o movimento de partículas de soluto (substância dissolvida em um solvente, como sal ou açúcar na água) de um meio mais concentrado para um menos concentrado, a osmose, no caso, refere-se especificamente ao movimento do solvente – quase sempre a água – através de uma membrana semipermeável.
Imagine, pois, uma membrana que permite a passagem da água, mas não das moléculas de certo soluto (como o sal). A osmose ocorre quando a água se desloca do lado onde ela está mais pura (menos concentrada em soluto) para o lado onde ela está menos pura (mais concentrada em soluto).
Esse movimento visa igualar as concentrações nos dois lados da membrana, em um processo espontâneo que não requer gasto de energia pela célula.
Em resumo, a osmose é a difusão da água através de uma membrana semipermeável.
Para que a osmose aconteça, três elementos são fundamentais:
O processo é impulsionado pela diferença de concentração de soluto entre dois meios separados por essa membrana.
A água fluirá sempre do meio com menor concentração de soluto (maior concentração de água, portanto) para o meio com maior concentração de soluto (menor concentração de água).
Esse fluxo persistirá até que as concentrações se igualem ou até que a pressão exercida pela coluna de água do lado mais concentrado impeça a passagem de mais solvente – conceito conhecido como pressão osmótica.
O processo de osmose pode ser visualizado na imagem a seguir:
Este é o cerne para qualquer questão sobre osmose e compreensão de seus efeitos. A classificação das soluções é sempre feita por comparação e determina o sentido do fluxo de água.
A imagem abaixo ilustra o comportamento do processo osmótico nas diferentes soluções, qual seja, hipertônica, isotônica e hipotônica.
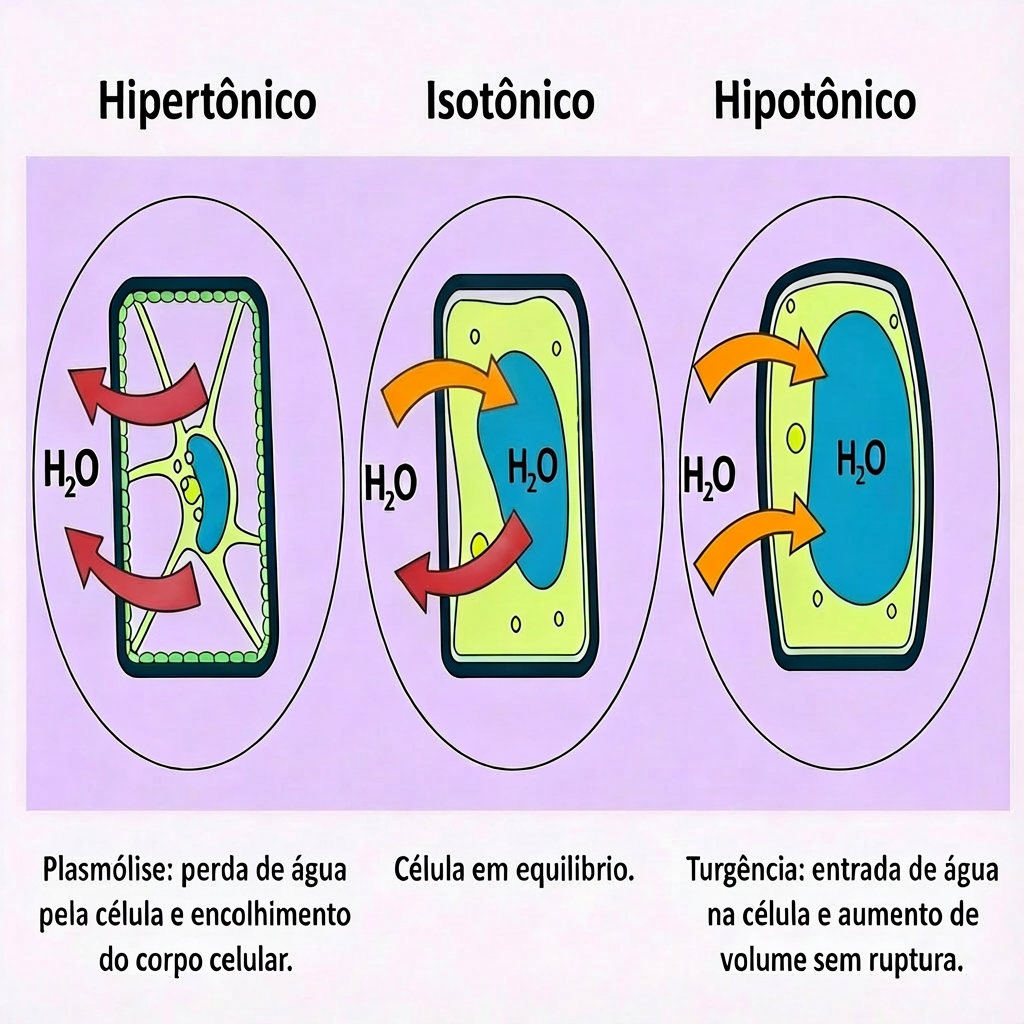
Células animais, como as nossas hemácias (glóbulos vermelhos), não possuem uma parede celular rígida. Por conseguinte, elas são muito sensíveis às variações de concentração no meio.
É por essa razão que não se pode injetar água destilada na veia como é feito com o soro, pois incharia as células e elas acabariam estourando (lise – hemólise). O soro que se toma em hospital geralmente é glicosado (contém açúcares) ou outros sais (como sódio, cloreto, potássio e outros), dependendo da finalidade.
Células vegetais possuem uma parede celular rígida de celulose, que confere proteção extra e modifica os efeitos da osmose.
É um conceito frequentemente cobrado em conjunto com a osmose. A pressão osmótica pode ser definida como a pressão externa mínima que deve ser aplicada a uma solução para impedir a entrada de solvente por osmose.
Em outras palavras, é a “força” ou “tendência” da água em entrar em uma solução mais concentrada. Quanto maior a concentração de soluto, maior a pressão osmótica da solução. Esse conceito é crucial para entender, por exemplo, como as raízes das plantas absorvem água do solo.
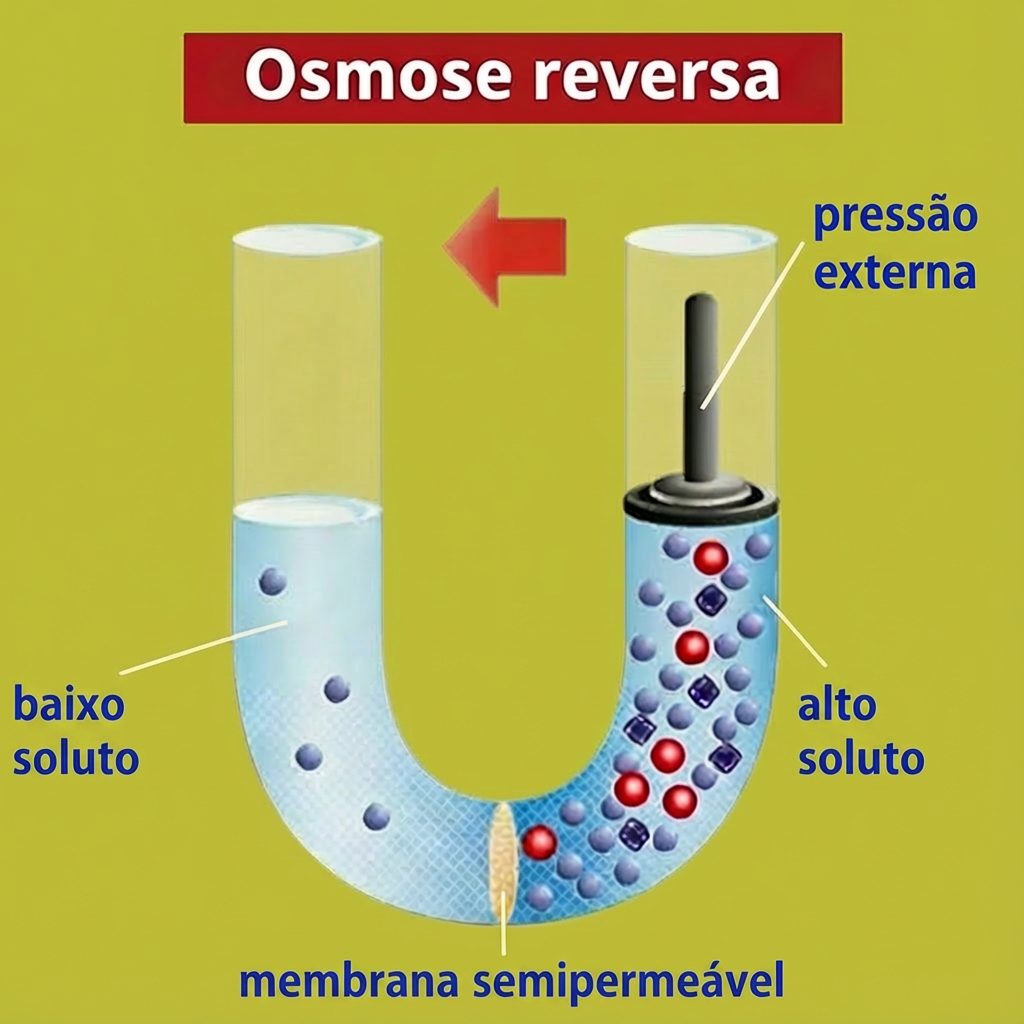
A osmose reversa é a aplicação tecnológica do conceito natural. Consiste em aplicar uma pressão externa maior que a pressão osmótica no lado da solução mais concentrada, forçando o solvente (água) a fluir no sentido inverso ao natural, ou seja, da solução concentrada para a diluída. Dessa forma, é possível, por exemplo, obter água pura a partir da água do mar. A osmose reversa é a base para:
A imagem a seguir ilustra o comportamento da osmose reversa que acabamos de analisar.
Essa é uma dúvida que pode ocorrer a muitos ao estudar o tema, ou mesmo na hora da prova.
Vamos, portanto, esclarecer a questão de forma didática através do infográfico comparativo abaixo. Dessa forma, você não terá mais dúvidas sobre as diferenças e semelhanças entre osmose e difusão.
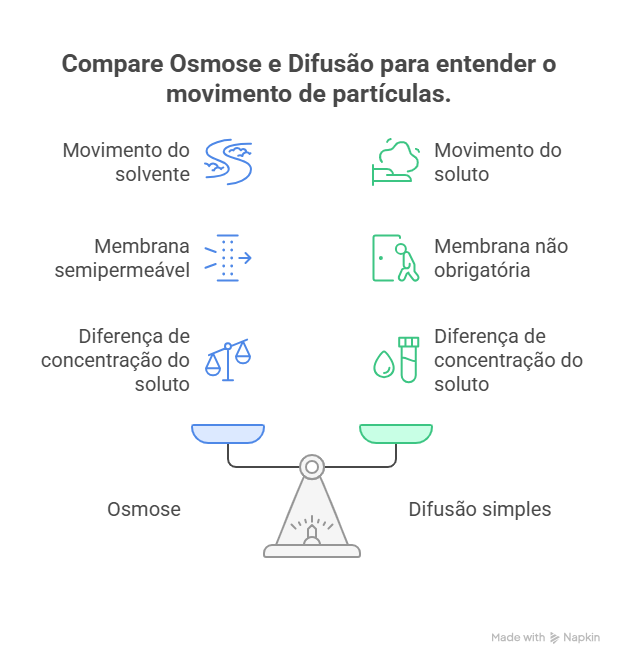
Em resumo, toda osmose é uma difusão (da água), mas nem toda difusão é uma osmose. A osmose, portanto, é um caso especial de difusão.
Para fixar o conceito, nada melhor que exemplos concretos:
Embora a osmose trate de um fenômeno biológico, não raro, esse termo está associado a expressões culturais, não ligadas, portanto, diretamente à biologia. Importante observar que essa extrapolação de significação pode ocorrer nas mais diversas áreas do conhecimento.
Como visto acima, osmose é o processo de trânsito molecular para dentro e fora da célula em busca de equilíbrio de concentração entre soluto e solvente. Por consequência, dado o processo osmótico, não raro, não raro a osmose é associada a comportamentos sociais descritos através de expressões como se pode ver a seguir.
Como frisado, a osmose é um processo que pertence às ciências naturais, biologia, mais especificamente.
No entanto, a sua aplicação foi além dessa área, assim, a osmose pode significar processos de integração social, de absorção ou difusão de ideias e aspectos culturais.
Por conseguinte, a osmose entre pessoas tem a acepção de inter-relações pessoais com troca de experiências sobre áreas do conhecimento e cultura.
“Viver por osmose” tem o significado da busca do aprendizado, ou a absorção de conhecimento, de forma natural, espontânea, sem a necessidade, portanto, de um esforço especificamente dirigido para tal fim. Isto é, a absorção de informações de maneira natural através do contato, da inter-relação com o meio ou de maneira intuitiva.
Como se pode notar, embora a expressão deriva da biologia, não tem vínculo direto com ela.
Por exemplo, a criança aprende naturalmente a língua de seus pais sem um esforço especificamente dirigido para esse aprendizado.
Para potencializar sua preparação e aprendizado para a prova, apresentamos a seguir modelos de questões que podem ser cobradas para testar seus conhecimentos.
(Enem-2012) Osmose é um processo espontâneo que ocorre em todos os organismos vivos e é essencial à manutenção da vida. Uma solução 0,15 mol/L de NaCℓ (cloreto de sódio) possui a mesma pressão osmótica das soluções presentes nas células humanas.
A imersão de uma célula humana em uma solução 0,20 mol/L de NaCℓ tem, como consequência, a
A- Absorção de íons Na+ sobre a superfície da célula.
B- Difusão rápida de íons Na+ para o interior da célula.
C- Diminuição da concentração das soluções presentes na célula.
D- Transferência de íons Na+ da célula para a solução.
E- Transferência de moléculas de água do interior da célula para a solução.
Resolução
No enunciado foi dito que uma solução 0,15 mol/L de NaCl possui a mesma pressão osmótico das soluções presentes nas células humanas. Sendo a osmose um tipo de transporte passivo onde as moléculas de água passam através das membranas de forma espontânea.
Quando da imersão de uma célula humana em solução de 0,20 mol/l de NaCl ocorrerá a transferência de moléculas de água da célula para a solução para que haja um equilíbrio químico em ambos os lados da membrana. Desidratando, portanto a célula. Resposta correta, letra E.
(Unesp-SP) No início da manhã, a dona de casa lavou algumas folhas de alface e as manteve em uma bacia, imersas em água comum de torneira, até a hora do almoço. Com esse procedimento, a dona de casa assegurou que as células se mantivessem:
A- Túrgidas, uma vez que foram colocadas em meio isotônico.
B- Túrgidas, uma vez que foram colocadas em meio hipotônico.
C- Túrgidas, uma vez que foram colocadas em meio hipertônico.
D- Plasmolizadas, uma vez que foram colocadas em meio isotônico.
E- Plasmolizadas, uma vez que foram colocadas em meio hipertônico.
Resolução: como visto acima, o meio hipotônico é aquele em que a concentração de soluto é menor na parte externa da célula. Por conseguinte, a água entra por osmose, o vacúolo central aumenta e a célula incha. A parede celular impede a lise. A célula fica túrgida (inflada, inchada), que é o estado ideal de sustentação da planta. Logo, resposta correta letra B.
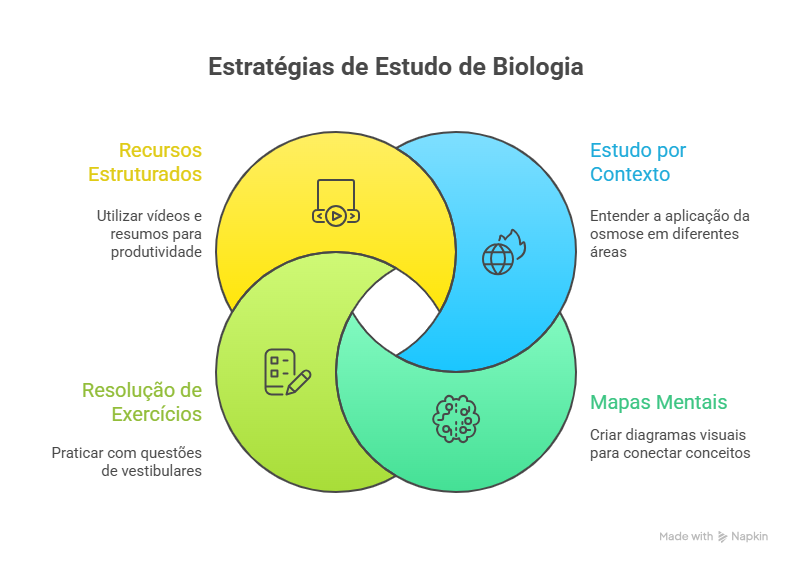
Para aprender de forma mais consistente sobre osmose, bem como outros conceitos do campo da biologia, apresentamos abaixo um infográfico com algumas dicas e técnicas de estudo que podem ser muito úteis na sua preparação para o Enem ou vestibular.
Aproveite e assista o vídeo do Professor Cunha sobre osmose e aprenda mais:
Quer levar seu estudo de Biologia e outras matérias para um nível mais elevado?
Para estudantes que desejam uma preparação completa, direta e alinhada com as exigências das principais provas, o Curso Professor Ferretto se destaca como uma autoridade no segmento.
Sua metodologia, que combina teoria objetiva com resolução massiva de exercícios, é ideal para quem precisa entender conceitos como a osmose de forma definitiva e aplicada.
O curso oferece uma estrutura que guia o aluno desde os fundamentos até os tópicos mais complexos, garantindo que nenhum detalhe importante fique para trás.
👉 Acesse também o curso gratuito do Professor Ferretto e experimente uma metodologia que já ajudou milhares de estudantes a alcançarem sua aprovação.
👉 Para um mergulho profundo e preparação completa para o Enem, explore os planos do Enem Anatomy.
A osmose é, portanto, muito mais que um termo de livro didático. É um princípio físico vital que governa processos desde a sustentação de uma planta até a purificação da água que bebemos.
Compreender seus mecanismos, os efeitos das soluções hipertônica, hipotônica e isotônica, e sua diferença para a difusão simples, é garantir pontos valiosos na sua prova.
Esperamos que este guia detalhado, repleto de exemplos e comparações, tenha esclarecido de vez o tema. Agora, com o conceito internalizado, você está preparado para enfrentar qualquer questão sobre osmose e seguir com confiança rumo à sua aprovação.
Bons estudos!
