
Assuntos de química que mais caem no Enem estão entre as principais dúvidas de quem estuda para a prova de...

A Tabela Periódica é um recurso essencial para quem se prepara para o ENEM e vestibulares, especialmente na disciplina de Química. Este artigo desmistifica a tabela, explicando a organização em períodos e grupos, além das propriedades periódicas fundamentais, como raio atômico e eletronegatividade. Entender a tabela é crucial para resolver questões com confiança e precisão. A lógica por trás da organização da Tabela Periódica ajuda a prever o comportamento dos elementos químicos que é frequentemente explorada nas provas. Compreender a tabela periódica como um mapa, vale muito mais do que a simples memorização dos elementos.
A Tabela Periódica é um recurso essencial para quem se prepara para o ENEM e vestibulares, especialmente na disciplina de Química. Este artigo desmistifica a tabela, explicando a organização em períodos e grupos, além das propriedades periódicas fundamentais, como raio atômico e eletronegatividade. Entender a tabela é crucial para resolver questões com confiança e precisão. A lógica por trás da organização da Tabela Periódica ajuda a prever o comportamento dos elementos químicos que é frequentemente explorada nas provas. Compreender a tabela periódica como um mapa, vale muito mais do que a simples memorização dos elementos.
Está se preparando para o ENEM ou vestibular e acredita que a Tabela Periódica é um monstro indecifrável? Relaxe! Pois vamos descomplicar para você.
Chega de decorar a Tabela Periódica! Entenda de vez o que são períodos, grupos, propriedades periódicas e muito mais.
Neste artigo, vamos desvendar os segredos da tabela, focando nos conceitos que mais caem nas provas, tais como:
Continue a leitura e você irá detonar nas provas!
Na área das ciências naturais, a Química é uma matéria bastante cobrada no ENEM e vestibulares. Não por menos, no centro desta disciplina está justamente a temida Tabela Periódica.
O que muitos não sabem, no entanto, é que ela não é um bicho de sete cabeças, mas o seu maior mapa do tesouro para acertar grande parte das questões de química em sua prova.
A Tabela Periódica, portanto, é um sistema organizado que revela padrões de comportamento dos elementos químicos, como a facilidade ou não de estabelecer ligações químicas.
Assim, entender essa lógica é a chave para prever propriedades e resolver exercícios com confiança.
Aproveite para conhecer uma abordagem moderna da Tabela Periódica com o professor Michel no vídeo abaixo 🤓
https://www.youtube.com/watch?v=jwr6lSLi5eE
Dmitri MENDELLEV começou a coletar dados a partir de 1869 dos elementos químicos conhecidos e começou a ordená-los segundo suas características. A partir dos dados coletados, começou a montar uma tabela.
Deixou inclusive espaços vazios em sua tabela, prevendo a existência de elementos ainda não descobertos na época. Por essa razão, é considerado o pai da Tabela Periódica Moderna.
A Tabela Periódica moderna é organizada com base no número atômico dos elementos e na repetição de propriedades periódicas.
Sua estrutura, portanto, não é aleatória, não é apenas um amontoado de letras e números que representam elementos químicos.
Pela posição de um determinado elemento químico na Tabela Periódica, é possível prever alguns de seus comportamentos como se verá a seguir.
Não por menos, uma das principais características da tabela é a sua organização em ordem crescente de número atômico (Z).
Aproveite para saber mais detalhes da origem da Tabela Periódica.
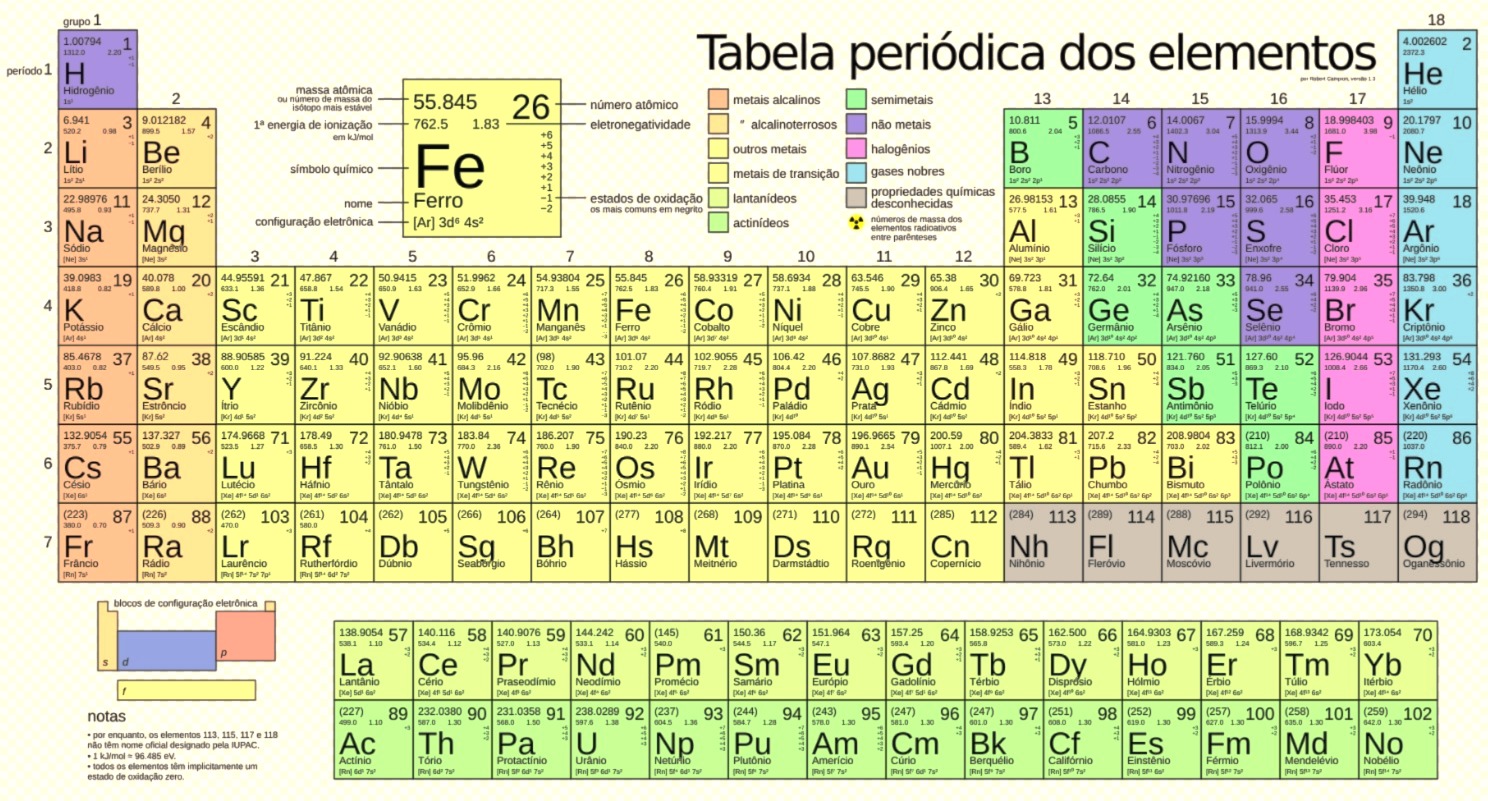
Imagem da Tabela Periódica dos elementos químicos com suas propriedades identificativas.
O Número Atômico (Z) é o CPF do elemento, é o que o distingue de forma única de outro elemento. Ou seja, ele nada mais é que o número de prótons no núcleo de um átomo.
Essa é uma informação fundamental, pois define a identidade do elemento. Justamente por estarem organizados em ordem crescente de número atômico, o Hidrogênio (H), que só tem um próton, está logo no início da tabela.
Já o Ouro (AU), que tem 79 prótons, como se verifica na tabela, ocupa posição bem mais a frente na tabela. Foi Henry Moseley que estabeleceu o número atômico como o principal princípio organizador da tabela periódica.
Ele mostrou que as propriedades dos elementos estavam mais intimamente relacionadas aos seus números atômicos do que às suas massas atômicas. Essa é, pois, a razão de se dizer que o número atômico é a identidade de um elemento químico.
Entenda mais detalhes sobre a Lei de Moseley.
Não! Não caia nessa pegadinha! Muita gente confunde esses dois conceitos no ENEM e no vestibular. Vamos esclarecer isso agora.
A Massa Atômica é a forma padrão para medir a massa dos átomos, expressa em unidade de massa atômica (u).
Os químicos resolveram tomar como base o carbono, por isso diz-se que a massa atômica é relativa. Foi determinado que uma unidade de massa atômica equivale a 1/12 da massa do carbono-12.
Esse é o motivo pelo qual a massa atômica é sempre um número decimal (números não inteiros, expressos com vírgula) localizado geralmente abaixo do símbolo do elemento. O Hélio (H), por exemplo, tem número atômico 2 (possui dois prótons), já o número de massa é 4,0026.
Na natureza podemos encontrar elementos químicos com o mesmo número atômico, mas com massas atômicas diferentes.
Estes elementos são chamados de isótopos, que nada mais são que átomos do mesmo elemento químico e que possuem o mesmo número de prótons, mas número diferente de nêutrons. Daí resulta terem massa atômica distinta. Simples assim.
Para exemplificar, pode-se citar o deutério e o trítio. Ambos são isótopos do hidrogênio. O deutério, assim como o hidrogênio, tem 1 próton, mas adicionalmente tem 1 nêutron, já o trítio conta com 2 nêutrons, mas também só 1 próton.
Resumo Rápido:
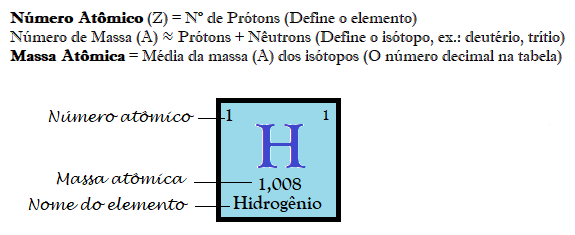
Representação de um elemento químico, com as principais características de identificação, como número atômico, massa atômica e nome do elemento.
Muito bem, já sabemos como identificar um elemento químico. Agora vamos ver o que são períodos e Grupos.
Períodos são as linhas horizontais (de cima para baixo, são 7). Eles indicam o número de camadas eletrônicas (níveis de energia) que o átomo possui, isto é, as camadas pelas quais os elétrons do átomo estão distribuídos.
O Gálio (Ga), por exemplo, está localizado no 4º período (quarta linha de cima para baixo), logo, possui 4 níveis eletrônicos, ou níveis de energia.
Os níveis de energia são nomeados pelas letras de K até Q, sendo K o primeiro e Q o último. Cada nível pode suportar um número máximo de elétrons, conforme a seguinte escala:
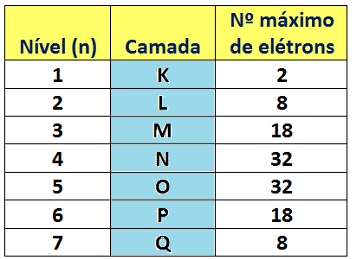
O átomo possui sete camadas de energia, representadas pelas letras K, L , M, N, O, P e Q. Cada camada de energia suporta determinado número de elétrons.
É por isso que os grupos também são chamados de famílias dos elementos. Veja os principais grupos ou famílias na tabela periódica abaixo:
Como isso cai na prova?
Uma questão clássica pede para você prever as propriedades de um elemento com base na sua posição. Exemplo: “O elemento “X” pertence à mesma família do Cloro. Podemos afirmar que ele tem tendência a _____ elétrons.” (Resposta: ganhar).
Veja como o professor Michel explica sobre as famílias e períodos da Tabela Periódica de uma forma lógica e prática no vídeo abaixo 🤓
https://www.tiktok.com/@professorferretto/video/7212771213691718918
As Propriedades Periódicas são a chave para prever comportamentos dos elementos químicos e é o que o ENEM e vestibulares adoram cobrar, daí a importância de conhecer as principais propriedades de um elemento químico.
Agora que você sabe se localizar no mapa, é hora de aprender sobre as propriedades periódicas representadas na tabela. Essas propriedades periódicas são características dos elementos químicos que se repetem de forma regular e previsível ao passo que aumenta o número atômico. Daí a importância de conhecê-las para garantir pontos preciosos na hora da prova.
As principais propriedades são o raio atômico a eletronegatividade e eletropositividade, conforme veremos abaixo.
No Período (da esquerda para a direita), o raio atômico DIMINUI. Por quê? O número atômico (Z) aumenta, colocando mais prótons no núcleo, logo, ele “puxa” os elétrons com mais força, tal como um imã, compactando o átomo. Logo, o raio aumenta da direita para a esquerda.
Já no Grupo (de cima para baixo), o raio atômico AUMENTA. Isso porque a cada novo período, uma nova camada eletrônica é adicionada, aumentando o tamanho do átomo.
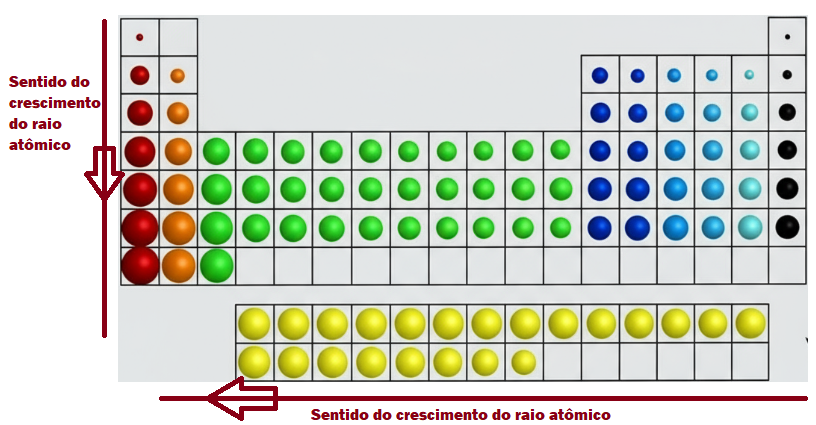
O raio atômico tem relação com os prótons no núcleo atômico. Na tabela periódica o raio atômico aumenta da direita para a esquerda e de cima para baixo.
A eletronegatividade é a “força de atração” que um átomo exerce sobre os elétrons de uma ligação química.
A tendência é que a eletronegatividade aumenta da esquerda para a direita (salvo os gases nobres) no período e de baixo para cima no grupo.
Não por menos, o Flúor (F) é o campeão de eletronegatividade! Localize-se o na tabela para uma melhor visualização e compreensão.
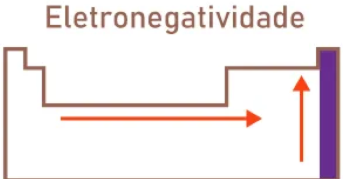
A eletronegatividade é a capacidade de um átomo atrair elétrons para realizar ligações químicas. Na Tabela Periódica o sentido da eletronegatividade é da esquerda para a direita e de baixo para cima.
Já a eletropositividade, é a tendência de um átomo de DOAR elétrons. Veja que é justamente o oposto da eletronegatividade. Logo, a eletropositividade segue o caminho contrário, é maior no canto inferior esquerdo da tabela, como o Frâncio (Fr), por exemplo.
| Tabela Resumo das Propriedades Periódicas: | |||
| Propriedade | Variação no PERÍODO (→) | Variação na FAMÍLIA (↓) | Elemento com Maior Valor |
| Raio Atômico | Diminui | Aumenta | Frâncio (Fr) |
| Eletronegatividade | Aumenta | Diminui | Flúor (F)* |
| Energia de Ionização | Aumenta | Diminui | Hélio (He) |
| Afinidade Eletrônica | Aumenta | Diminui | Cloro (Cl) * |
| Caráter Metálico | Diminui | Aumenta | Frâncio (Fr) |
| *O Flúor tem a afinidade eletrônica menor que o Cloro devido ao seu tamanho muito pequeno, que causa repulsão, mas para o ENEM, considere a tendência geral. | |||
As provas não exigem, nem querem, que você decore a tabela. Elas avaliam se você compreende a sua lógica, se você entendeu o mapa da química representado através da tabela periódica.
Você pode se deparar com questões que:
Aplicação prática no ENEM: A eletronegatividade determina o tipo de ligação química. Diferenças grandes resultam em ligações iônicas (ex.: NaCl), enquanto diferenças pequenas resultam em ligações covalentes (ex.: CH4). Questões sobre polaridade de moléculas dependem diretamente desse conceito.
I -Na mitologia grega, Nióbia era filha de Tântalo, dois personagens conhecidos pelo sofrimento. O elemento químico de número atômico (Z) igual a 41 tem propriedades químicas e físicas tão parecidas com as do elemento de número atômico 73 que chegaram a ser confundidos.
Por isso, em homenagem a esses dois personagens da mitologia grega, foi conferido a esses elementos os nomes de nióbio (Z = 41) e tântalo (Z = 73). Esses dois elementos químicos adquiriram grande importância econômica na metalurgia, na produção de supercondutores e em outras aplicações na indústria de ponta, exatamente pelas propriedades químicas e físicas comuns aos dois.
a) Terem elétrons no subnível f.
b) Serem elementos de transição interna.
c) Pertencerem ao mesmo grupo na tabela periódica.
d) Terem seus elétrons mais externos nos níveis 4 e 5, respectivamente.
e) Estarem localizados na família dos alcalinos terrosos e alcalinos, respectivamente.
Solução: Olhando na tabela, tanto o Nióbio quanto o Tântalo, pertencem ao mesmo grupo/família (grupo 5). Somente com essa informação, verifica-se que a alternativa “c” é a correta.
II – No ar que respiramos existem os chamados “gases inertes”. Trazem curiosos nomes gregos, que significam “o Novo”, “o Oculto”, “o Inativo”. E de fato são de tal modo inertes, tão satisfeitos em sua condição, que não interferem em nenhuma reação química, não se combinam com nenhum outro elemento e justamente por esse motivo ficaram sem ser observados durante séculos: só em 1962 um químico, depois de longos e engenhosos esforços, conseguiu forçar “o Estrangeiro” (o xenônio) a combinar-se fugazmente com o flúor ávido e vivaz, e a façanha pareceu tão extraordinária que lhe foi conferido o Prêmio Nobel.
a) Densidade.
b) Condutância.
c) Eletronegatividade.
e) Estabilidade nuclear.
e) Temperatura de ebulição.
Solução: Ao se verificar a orientação da eletronegatividade na tabela, nota-se que o Flúor tem alta eletronegatividade. Logo, resposta correta letra “c”. A eletronegatividade também tem a ver com reatividade, mas reatividade química não consta como opção de resposta.
I – Determinado elemento metálico pertence ao terceiro período da Classificação Periódica e apresenta dois elétrons em seu nível eletrônico mais energético. Esse elemento, comumente empregado em medicamentos para o combate à azia, é representado pelo símbolo:
a) K.
b) Ca.
c) Na.
d) Mg.
e) Mn.
Solução: Para começar, somente o Sódio (Na) e o Magnésio (Mg) pertencem ao terceiro período, os demais são do quarto. Como você já sabe, o sódio está presente no sal e o magnésio no tal “leite de magnésio”, que se toma justamente quando se está com azia. De se ver que mesmo sem conhecimento aprofundado é possível resolver corretamente a questão. Por conseguinte, alternativa correta letra “d”.
II – Com relação ao elemento químico, pode-se afirmar corretamente que:
a) O número de nêutrons é o que o caracteriza.
b) É o conjunto de átomos que têm o mesmo número de prótons e de nêutrons.
c) Podem existir átomos diferentes, com diferentes números de nêutrons pra um mesmo elemento químico.
d) É caracterizado pelo número de elétrons, não importando o número de prótons que os átomos possuam.
Solução: Acima foi visto que podem existir átomos de um mesmo elemento químico com diferentes números de neutros de um mesmo elemento químico. Basta lembrar do deutério e do trítio, isótopos. Assim, resposta, letra “c”.
Para fazer uma ótima pontuação na prova, uma estratégia vencedora é a compreensão contextual. Como visto acima, a Tabela Periódica tem uma organização lógica.
Por consequência, compreender essa organização faz reconhecer características e comportamentos dos elementos. Desnecessário, portanto, decorar todos os elementos, foque nos elementos “personagens”, nos que são os atores principais das reações químicas, como indicado abaixo:
Outra dica é utilizar a Tabela para resolver as questões logicamente. Ao se deparar com uma questão que envolve a comparação de dois elementos, siga estes passos:
Considere os elementos: I. Mg (Z=12); II. S (Z=16); III. Cl (Z=17); IV. Ca (Z=20). Qual deles tem o maior raio atômico?
Resolução:
Entender a Tabela Periódica vai muito além de saber onde fica o Oxigênio ou o Ferro. Significa compreender a linguagem da Química e ter a habilidade de prever como os elementos se comportam.
Importante, pois, revisar os conceitos de período, grupo, família dos elementos e as propriedades periódicas como raio atômico e eletronegatividade, uma vez que é um passo decisivo para obter êxito no ENEM ou garantir sua vaga no ensino superior através do vestibular.
A Tabela Periódica é seu mapa! Assim, utilize-a de forma inteligente, pois ela permite que você responda questões complexas com base em padrões lógicos e previsíveis.
É por isso que dominar os conceitos de número atômico, massa atômica, famílias, períodos, raio atômico e eletronegatividade não é apenas “saber química”; é ter uma estratégia para o sucesso no ENEM e no vestibular.
E para você que quer uma estratégia de estudos comprovada, que ensina você a pensar como a prova quer, o curso da nossa plataforma é a ferramenta ideal.
Com aulas didáticas e exercícios específicos, a plataforma Professor Ferretto é importante para consolidar esse e todos os outros conteúdos necessários para passar! Não deixe seu sonho para depois, acesse nosso site e conheça os planos disponíveis!
A plataforma é um guia do zero até a aprovação! Venha conosco e detone nas provas.

