
Assuntos de química que mais caem no Enem estão entre as principais dúvidas de quem estuda para a prova de...

Radioatividade, o que é? Tipos de radiação. Uso na geração de energia elétrica, medicina e indústria. Possíveis riscos ambientais. Como o assunto é cobrado no ENEM e vestibulares.
O conceito de radioatividade é fundamental para entender fenômenos naturais e artificiais relacionados ao decaimento de elementos químicos. No contexto do ENEM, é importante compreender os diferentes tipos de radiação (alfa, beta e gama) e as suas aplicações em áreas como medicina, indústria e geração de energia. Além disso, é relevante associar a radioatividade aos impactos ambientais e à saúde humana, especialmente em situações de exposição prolongada.

Radioatividade
Certamente você já viu essa imagem icônica de um trifólio preto sobreposto a um fundo amarelo que parece gritar: perigo, radioatividade! Já se perguntou, no entanto, o que de fato é radioatividade? E, além disso, como um tema tão emblemático pode ser cobrado no ENEM ou em um vestibular?
Sendo sua resposta positiva, acredite, você está no lugar certo. Preparamos este artigo para esclarecermos essas questões e para que ele sirva de subsídio para você ter êxito em sua prova. Nossa intenção é apresentar elementos estratégicos de estudo, com intuito de sanar suas dúvidas e, consequentemente, antecipar o que pode cair nas provas.
Ao longo deste artigo, vamos desmistificar a radioatividade. Por isso, além de um apanhado histórico, falaremos dos conceitos fundamentais da radioatividade, dos principais tipos de radiação, bem como de suas aplicações no nosso dia a dia. Tudo isso, obviamente, sempre com vistas a abarcar o que os editais do ENEM e vestibulares costumam cobrar do assunto.
Vamos mergulhar nesse incrível mundo atômico e conhecer as leis que regem a radioatividade.
Em palavras rápidas, radioatividade é a propriedade que certos núcleos atômicos instáveis possuem de emitir espontaneamente partículas e ondas eletromagnéticas para alcançar a estabilidade.
Note que na natureza tudo tende a achar um ponto de equilíbrio, isto é, o de maior estabilidade energética. É por essa mesma razão que a água sempre corre para os níveis mais baixos de um relevo. No nível atômico, embora as coisas possam parecer um tanto exóticas, ocorre algo semelhante.
Imagine um núcleo atômico com excesso de energia ou partículas. Esse excesso de energia cria instabilidade e é por isso que esse núcleo atômico acaba por liberar a energia adicional em forma de partículas ou ondas, que é o que se chama radiação. Importante lembrar que esse fenômeno é espontâneo e não pode ser acelerado ou retardado por fatores externos como temperatura ou pressão.
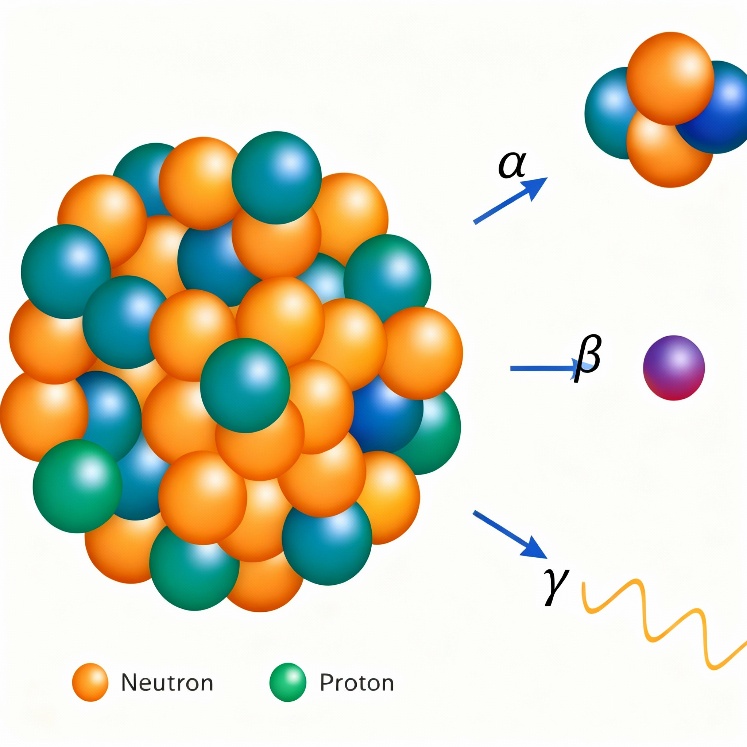
Tipos de radiação nuclear
Após o rápido apanhado histórico sobre a descoberta da radioatividade visto acima, vamos agora nos aprofundar em seus diferentes tipos. A radioatividade se manifesta principalmente através da emissão de três tipos de radiação, cada uma com propriedades distintas. Conhecer essas características é crucial para resolver questões em sua prova de ENEM ou vestibular.
Acesse o vídeo do Prof. Michel e saiba mais sobre tipos de radiação de forma clara e prática.
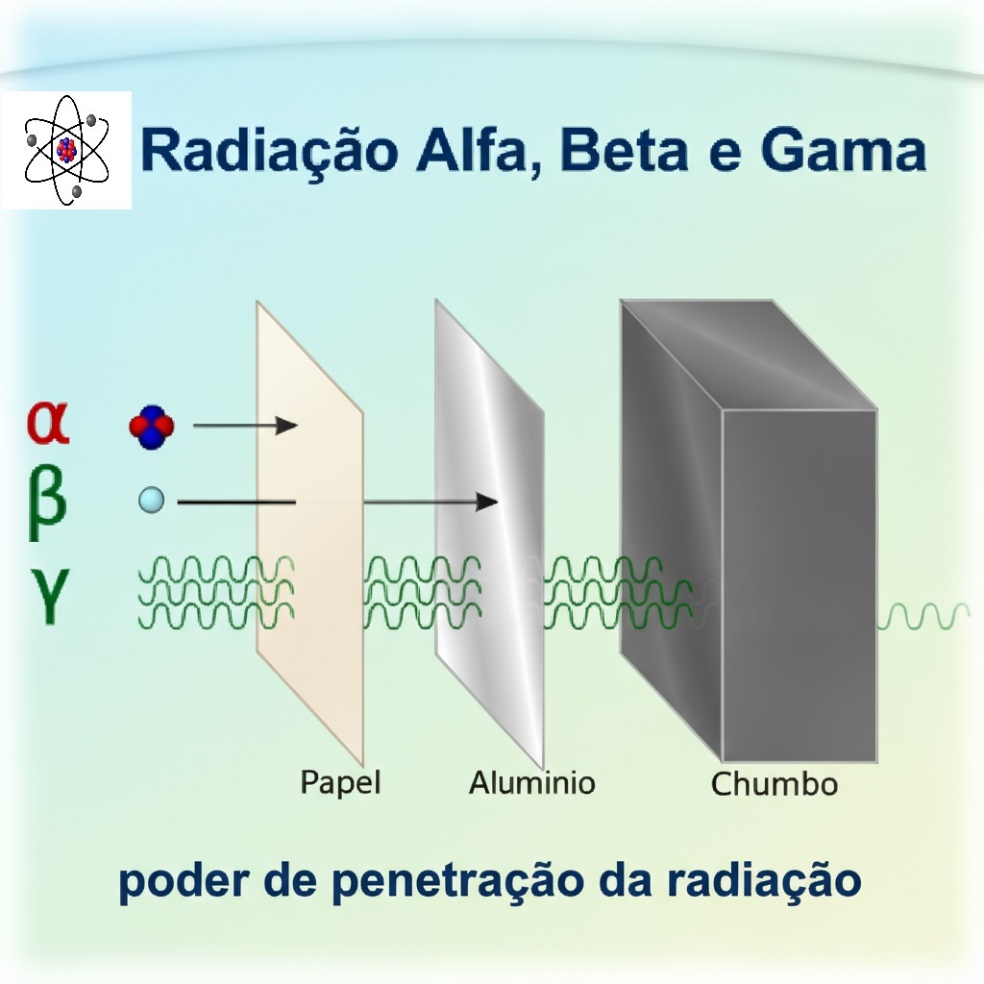
Poder de penetração dos diferentes tipos de radiação.
Agora que já conhecemos os tipos de radiação, vamos nos familiarizar com as leis da radioatividade. Essas leis foram propostas por Rutherford e Soddy e descrevem o comportamento dos elementos durante o decaimento radioativo. Não se preocupe, por enquanto, com o que é decaimento radioativo, pois já veremos isso na sequência. Por hora, fixemos nossa atenção nas duas leis da radioatividade.
Segunda Lei (lei do decaimento beta β): quando um átomo emite uma partícula β, seu número atômico (Z) aumenta 1 unidade, e o número de massa (A) permanece o mesmo.
Vimos acima que a radiação gama não causa mudança na identidade do núcleo, pois apenas perde energia, mas não emite partículas.
O decaimento radioativo é a transformação de um núcleo instável (pai) em um núcleo mais estável (filho), com emissão de radiação.
Note que o decaimento radioativo é um processo probabilístico e espontâneo. A velocidade de desintegração é proporcional ao número de átomos radioativos presentes na amostra.
Exemplo 1: Decaimento Alfa do Urânio-238
O Urânio-238 (₉₂U²³⁸) emite uma partícula α (₂He⁴). Aplicando a Primeira Lei:
Exemplo 2: Decaimento Beta do Carbono-14
O Carbono-14 (₆C¹⁴) é usado na datação de fósseis. Um nêutron se transforma em um próton, emitindo um elétron (β⁻).
Não, não é a mesma coisa. O decaimento, como acabamos de falar, é a transformação de um núcleo instável em um núcleo mais estável através da perda de partículas ou energia, isto é, emissão de radiação.
Já a meia-vida de um elemento radioativo é o tempo necessário para que metade de um elemento radioativo se reduza à metade, isto é, metade desse elemento já não será mais radioativo.
Esse processo também é conhecido como semidesintegração. Note, pois, que após o transcurso desse tempo o material radioativo restante será apenas a metade da inicial, daí chamar-se meia-vida.
O tempo necessário para que a metade dos átomos de uma amostra radioativa sofra decaimento não é único. É uma constante característica de cada isótopo radioativo, portanto.
Há elementos com meia-vida bem curtas, outros, bem longa. Vejamos alguns exemplos:
O carbono-15 tem meia-vida de só 2,4 segundos. Já o carbono-14 é de 5.730 anos, daí ser tão útil na datação em estudos paleontológicos. O césio-137 tem meia vida de 30,17 anos. E o urânio-235 tem meia-vida bem longa, aproximadamente 703,8 milhões de anos.
Como se pode ver, rejeitos radioativos que contenham resquícios de Urânio-235 de fato podem ser um grande problema, justamente por sua meia-vida longa. Podendo causar danos ambientais por até milhões de anos.
O uso de substâncias radioativas vai muito além da construção de uma bomba atômica. Podemos, por exemplo, citar sua utilização nas seguintes atividades:
Menina sendo preparada para sessão de radioterapia.
Vimos que a característica natural de alguns elementos químicos emitirem radiação pode ser explorada em diferentes áreas da atividade humana. O manejo incorreto de materiais radioativos, contudo, pode levar a acidentes graves com contaminação do solo e da água, como em Chernobyl, na Rússia (1986) e Fukushima, Japão (2011).
A exposição à radiação pode causar desde queimaduras até doenças graves como câncer e danos genéticos irreparáveis. Não por menos o símbolo da radioatividade, de que falamos logo no início deste artigo, é universalmente reconhecido como um alerta de perigo.
O lixo radioativo (rejeitos), por essa razão, deve ser armazenado e isolado de forma apropriada e com segurança. Os rejeitos radioativos costumam ficar isolados até que seu nível de radiação seja igual ou inferior ao do próprio meio ambiente, justamente para que não apresentem mais toxidade química aos organismos vivos.
A radioatividade é um tópico frequente nesse tipo de provas, e as questões costumam ser interdisciplinares, envolvendo Química, Física e Biologia. As bancas buscam avaliar se você compreende o conceito, e não apenas decorar fórmulas.
Nesse sentido, pode-se dizer que as abordagens mais comuns são:
Exemplo de Questão Estilo Enem:
(Enem/2015) O carbono-14, ¹⁴C, é um isótopo radioativo natural do carbono que se forma na atmosfera pela ação de nêutrons cósmicos. Esse isótopo decai pela emissão de uma partícula beta, transformando-se no nitrogênio-14, ¹⁴N, com uma meia-vida de 5.730 anos. A datação por carbono-14 é uma ferramenta importante para a determinação da idade de fósseis.
A equação nuclear que representa o decaimento do carbono-14 é:
a) ¹⁴C → ¹⁴N + ₋₁β⁰
b) ¹⁴C → ¹⁴B + ₊₁β⁰
c) ¹⁴C → ¹⁵N + ₋₁β⁰
d) ¹⁴C → ¹³N + ₊₁β⁰
e) ¹⁴C → ¹²C + ₂He⁴
Resposta Correta: A. A emissão beta (β⁻) transforma um nêutron em um próton, aumentando o número atômico de 6 (C) para 7 (N), sem alterar o número de massa.
(ENEM/2022) As usinas nucleares utilizam o princípio da fissão nuclear para gerar energia elétrica. Dentro do reator, nêutrons colidem com átomos de urânio, que se dividem em dois novos átomos, liberando de dois a três nêutrons do núcleo, em uma reação em cadeia. Esse processo libera muito calor, que é utilizado para gerar energia. Porém, é necessário um sistema de arrefecimento para evitar uma explosão. Para isso, a água captada de fontes naturais circula em um sistema fechado e depois volta para o meio ambiente.
Caso esse sistema não ocorra de maneira adequada, será gerado um impacto negativo porque:
A) produzirá gases tóxicos.
B) diminuirá a reserva hídrica local.
C) aquecerá os sistemas aquáticos.
D) aumentará a disponibilidade de nutrientes.
E) permitirá a contaminação por micro-organismos.
Ao se ler com atenção a questão, nota-se que a resposta praticamente já nos é dada, pois fala de sistema de arrefecimento das instalações da usina. Se o processo de arrefecimento não é bem executado, devolverá água aquecida para o meio ambiente, podendo prejudicar a vida aquática nas cercanias. Logo, resposta correta letra C.
(Ufrgs 2018) Assinale a alternativa que preenche corretamente as lacunas do enunciado abaixo, na ordem em que aparecem.
Quando um núcleo de urânio 238U92 absorve um nêutron, forma-se o núcleo 239U92, que é radioativo com meia-vida de 24 minutos.
Núcleos de urânio 239U92 emitem radiação ___, transformando-se em núcleos de netúnio 239Np93. Esse isótopo de netúnio também é radioativo com meia-vida de 2,3 dias.
Ao emitirem radiação ___, os núcleos de netúnio 239Np93 transformam-se em núcleos de plutônio 239Pu94, cuja meia-vida é cerca de 24.000 anos.
A) α-β
B) α-γ
C) β-α
D) β-β
E) β-γ
Como visto acima, conforme a segunda lei da radioatividade, as emissões beta (β) aumentam o número atômico. Nos dois enunciados notamos que o número atômico aumenta. No primeiro de U92 para Np93 e no segundo de Np93 para Pu94. Por conseguinte, estamos falando de radiação beta. Alternativa correta letra D.
Qual é a importância da radioatividade?
A radioatividade é fundamental para a vida na Terra. Em torno de 50% do calor da Terra é mantido por decaimento radioativo, fundamental para a dinâmica interna do nosso planeta. Tendo inclusive relação com o campo eletromagnético da Terra que nos protege da radiação solar e inclusive interestelar, também chamada de radiação cósmica.
Além disso, como ilustrado acima, a radioatividade é utilizada tanto na medicina para diagnósticos e tratamentos de cânceres. Também é utilizada na produção de energia, principalmente em regiões ou países com pouco potencial hidrelétrico. A radioatividade ainda é importante na indústria, principalmente para detecção de falhas na produção de determinadas peças ou estruturas mais sensíveis. A radioatividade é uma ferramenta útil para avanços na pesquisa científica.
O que são elementos radioativos?
São elementos químicos que possuem pelo menos um isótopo com núcleo instável, passível de sofrer decaimento radioativo espontâneo em busca de estabilidade energética. Exemplos: Urânio (U), Rádio (Ra), Polônio (Po), Césio-137 (Cs-137), Cobalto-60 (Co-60).
O micro-ondas e o celular são radioativos?
Não. Eles não são radioativos, pois emitem apenas radiação eletromagnética, mas não do tipo ionizante (como a radiação gama ou raios-X). A radiação do micro-ondas e do celular é de baixa energia e não é capaz de remover elétrons dos átomos. Portanto, embora seja uma espécie de radiação, não é o tipo que é designado como radioatividade e que pode ter potencial lesivo para o ser humano.

Usina nuclear du Bugey – França.
Dominar a radioatividade química e física exige mais do que leitura; exige prática. Para consolidar todo esse conhecimento e aprender a aplicá-lo nos formatos de questão do Enem e vestibulares, a metodologia certa faz toda a diferença.
Plataformas especializadas, como o Curso Gratuito do Professor Ferretto, oferecem um plano de estudos estruturado, videoaulas objetivas e milhares de exercícios resolvidos que abordam exatamente esses pontos. Essa é uma forma eficiente de transformar um tema complexo em um dos seus maiores trunfos na prova.
Acesse agora o Curso Gratuito do Professor Ferretto e descubra como a nossa plataforma pode potencializar seus estudos em Química, Física e todas as demais matérias que caem no ENEM e nos principais vestibulares do país.
Aproveite para conhecer a nova plataforma Pro no site do Professor Ferretto!
A radioatividade é, sem dúvida, um dos pilares da ciência moderna. Compreender seus fundamentos – desde o que é e os tipos de radioatividade até suas leis, aplicações e riscos – não é apenas uma necessidade para se sair bem no ENEM e nos vestibulares, mas também um instrumento para formar uma visão crítica sobre um tema tão relevante para a sociedade.
Esperamos que este guia tenha clareado suas dúvidas e servido como um mapa para seus estudos. Agora, é colocar a mão na massa, praticar com questões e conquistar sua vaga na universidade! Nos vemos no próximo artigo, até mais!

