
Assuntos de quûÙmica que mais caem no Enem estûÈo entre as principais dû¤vidas de quem estuda para a prova de...

TermoquûÙmica ûˋ um ramo da FûÙsico-QuûÙmica que estuda as quantidades de calor envolvidas em reaûÏûçes quûÙmicas e mudanûÏas de estado. û essencial em provas como o ENEM, pois aborda conceitos fundamentais como reaûÏûçes exotûˋrmicas e endotûˋrmicas, entalpia e a Lei de Hess. A disciplina ûˋ aplicada em vûÀrias ûÀreas, desde o cûÀlculo de poder calorûÙfico de combustûÙveis atûˋ o desenvolvimento de baterias e a compreensûÈo do metabolismo humano. Para se preparar bem para o ENEM e vestibulares, ûˋ importante entender nûÈo sû° a teoria, mas tambûˋm como ela se apresenta em situaûÏûçes prûÀticas e exercûÙcios. Questûçes de TermoquûÙmica no ENEM podem incluir grûÀficos de energia, interpretaûÏûÈo de fenûÇmenos cotidianamente ocorridos a partir dos conceitos aprendidos, e cûÀlculos usando a Lei de Hess. O domûÙnio dos conceitos chave, como a variaûÏûÈo de entalpia, e a prûÀtica constante sûÈo fundamentais para aumentar a confianûÏa e o desempenho nas provas.
OlûÀ, estudante! Quer dominar TermoquûÙmica para mandar bem no ENEM ou em algum vestibular? Estamos com vocûˆ! Hoje vamos lhe explicar o que ûˋ termoquûÙmica. Alûˋm disso, vamos aprender a identificar uma reaûÏûÈo exotûˋrmica e endotûˋrmica, bem como analisar a Lei de Hess.
Veremos que a termoquûÙmica estûÀ diretamente vinculada com fenûÇmenos do nosso dia a dia, desde o simples ato de cozinhar atûˋ na indû¤stria que move o mundo. Vamos juntos descomplicar conceitos e ao final vocûˆ saberûÀ como a termoquûÙmica ûˋ cobrada nas provas com exemplos reais e lhe forneceremos as melhores dicas de estudo para conquistar sua sonhada nota. LûÀ vamos nû°s!
Em sua definiûÏûÈo mais direta, aô TermoquûÙmicaô ûˋ o ramo da FûÙsico-QuûÙmica que estuda as quantidades de calor (energia) envolvidas nas reaûÏûçes quûÙmicas e nas mudanûÏas de estado fûÙsico da matûˋria.
NûÈo por menos, ela responde a perguntas fundamentais como:
Para ilustrar melhor, veja abaixo algumas aplicaûÏûçes da termoquûÙmica no mundo real:
Para dominar aô TermoquûÙmica, ûˋ essencial ter clareza sobre seus conceitos fundamentais. Por essa razûÈo, vamos explorar cada um deles, comô fû°rmulas essenciais e exemplos prûÀticos. Alûˋm disso, ûˋ bom que se tenha uma boa compreensûÈo de como os elementos sûÈo distribuûÙdos na tabela periû°dica pelas suas caracterûÙsticas.
Esta classificaûÏûÈo, a dos tipos de reaûÏûçes, ûˋ um dos quesitos mais cobrados em provas. Na verdade, o tipo de reaûÏûÈo se resume ao fluxo de calor entre o sistema (a reaûÏûÈo) e as vizinhanûÏas (o ambiente). Vejamos, pois, cada uma das reaûÏûçes de forma mais detida.

ReaûÏûÈo exotûˋrmica e endotûˋrmica.
Aô Entalpia (H) ûˋ a medida da energia total de um sistema. Esse total de energia pode ser alterado mediante reaûÏûçes quûÙmicas. Como nûÈo podemos medir o valor absoluto de H, isto ûˋ, da entalpia em um sistema, o que importa na TermoquûÙmicaô ûˋ aô variaûÏûÈo de entalpia (öH), tambûˋm conhecida comoô calor de reaûÏûÈo. Ou seja, o calor emitido ou absorvido durante uma reaûÏûÈo quûÙmica.
Por essa reaûÏûÈo temos a seguinte fû°rmula essencial:
Onde öH ûˋ a variaûÏûÈo da energia total de um sistema. E como essa variaûÏûÈo pode ser medida? Simples, mede-se o calor gasto ou absorvido durante a reaûÏûÈo quûÙmica. DaûÙ öH ser igual a entalpia dos produtos (H produtos), menos a entalpia dos reagentes (H reagentes).
A variaûÏûÈo da entalpia tambûˋm costuma ser representada como öH = Hi ã Hf (Hi ûˋ a entalpia inicial a Hf entalpia final)
Como uma reaûÏûÈo quûÙmica pode emitir ou absorver calor temos as seuintes possibilidades:
Os principais tipos de öH que vocûˆ precisa conhecer sûÈo:
Aô Lei de Hessô afirma queô a variaûÏûÈo de entalpia de uma reaûÏûÈo quûÙmica depende apenas dos estados inicial e final, e nûÈo do caminho percorrido.
O que significa isso? Que a variaûÏûÈo da entalpia ûˋ uma funûÏûÈo de estado. Isso ûˋ, ela mede um estado inicial e um estado final, apenas isso. Ela nûÈo se ocupa com o meio percorrido, o processo para se chegar do estado inicial ao estado final.
Saiba mais sobre a Lei de Hess no vûÙdeo do professor Michel abaixo:
Como usar a Lei de Hess?
Em termos prûÀticos, isso se torna muito û¤til, pois pode-se podemos somar equaûÏûçes termoquûÙmicas como se fossem equaûÏûçes matemûÀticas para obter a equaûÏûÈo termoquûÙmica e a öH desejados.
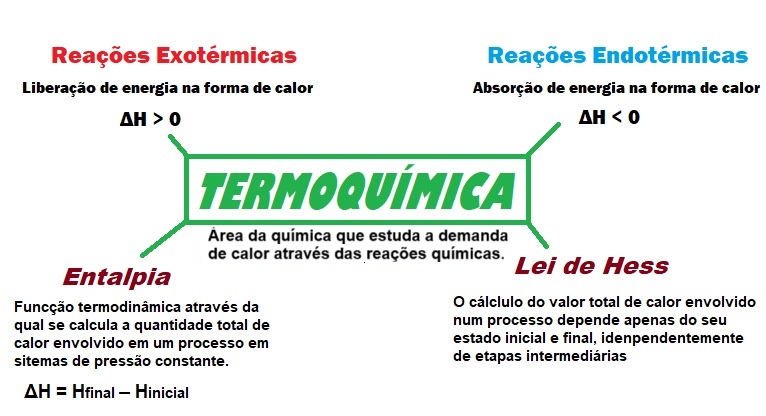
ûrea da termoquûÙmica: reaûÏûçes exotûˋrmicas e endotûˋrmica; entalpia e Lei de Hess.
Vamos ilustrar:
Etapa I (ou reaûÏûÈo I), imagine que vocûˆ tenha dois reagents A e B. Ao juntûÀ-los vocûˆ provocarûÀ uma reaûÏûÈo que resultarûÀ no produto AB e que terûÀ determinada variaûÏûÈo de entalpia. Podemos, entûÈo, escrever isso da seguinte forma:
ReaûÏûÈo I: A + B ã AB öHI
Imagine agora, de forma anûÀloga, a Etapa II (ou reaûÏûÈo II). Podemos escrevûˆ-la como segue:
ReaûÏûÈo II: AB + C ã AC + B öHII
Agora, com base na Lei Hess, podemos manipular essas equaûÏûçes termoquûÙmicas como se fossem equaûÏûçes matemûÀticas. Logo, se juntarmos a reaûÏûÈo I coma reaûÏûÈo II, teremos:
A + B + AB + C ã AB + AC + B
Agora basta simplificar (excluir as que aparecem em ambos os lados). Resultando em:
A + C ã AC
A öH (variaûÏûÈo da entalpia) dessa reaûÏûÈo serûÀ justamente a soma de öHI com öHII, simples assim!
Passo a Passo:
O passo a passo, portanto, ûˋ proceder como se orienta abaixo:
Parta do pressuposto que haja o interesse em determinar a variaûÏûÈo da entalpia que envolve a reaûÏûÈo 3 CO2(g) + 4 H2O(l) ã C3H8(g)+5 O2(g).
Essa reaûÏûÈo de interesse envolve trûˆs outras reaûÏûçes, conforme descritas abaixo.
Queima do propano (C3H8) que envolve oxigûˆnio (O2) e libera gûÀs carbûÇnico e ûÀgua.
C3H8(g)+5 O2(g) ã 3 CO2(g) + 4 H2O(l) öH = -2220 KJ
JûÀ a segunda equaûÏûÈo ûˋ a queima de carbono, tambûˋm liberando diû°xido de carbono.
C + O2(g) ã CO2(g) öH = -394 KJ
Por fim, uma reaûÏûÈo de higrogûˆnio com oxigûˆnio que produz vapor dãûÀgua.
H2 (g) + ô§ O2 (g) ã H2O (l) öH = -286 KJ
Contudo, como a Lei de Hess nos diz que podemos manipular essas equaûÏûçes como equaûÏûçes matemûÀticas, podemos inverter essas equaûÏûçes de reaûÏûçes quûÙmicas para efeito de cûÀlculo de calor gasto ou absorvido, ainda que inverter certa reaûÏûÈo quûÙmica na prûÀtica seja inviûÀvel ou praticamente impossûÙvel.
Assim, invertemos a equaûÏûÈo da queima do propano e temos a equaûÏûÈo de interesse:
3CO2(g) + 4 H2O(l) ã C3H8(g)+5 O2(g) = + 2220 KJ (como invertemos a equaûÏûÈo, tambûˋm se inverte o sinal do calor gasto).
A segunda equaûÏûÈo C + O2(g) ã CO2(g) öH = -394 KJ multiplicaremos essa equaûÏûÈo por 3 para que tenha a mesma quantidade de CO2 que a primeira, logo:
3C (g) + 3O2(g) ã 3CO2(g) öH = -1182 KJ
Por fim, nota-se que a reaûÏûÈo de interesse requer 4 mols de H2. A û¤nica que tem essa substûÂncia ûˋ a quatro. Assim para equalizer a equaûÏûÈo a multiplicamos por 4 e temos:
4H2 (g) + 2O2 (g) ã 4H2O (l) öH = -1184 KJ
Agora basta juntar as equaûÏûçes e fazer as simplificaûÏûçes, conforme demonstra a ilustraûÏûÈo abaixo.
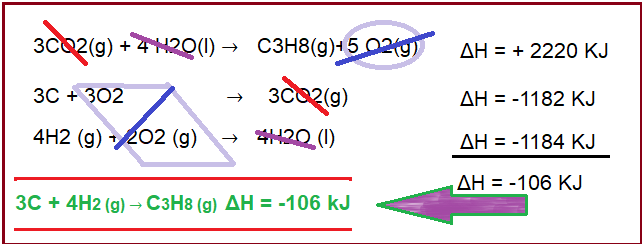
SimplificaûÏûÈo de reaûÏûçes quûÙmicas – variaûÏûÈo da entalpia.
Aô TermoquûÙmica no Enemô vai muito alûˋm da simples pergunta “essa reaûÏûÈo ûˋ endotûˋrmica ou exotûˋrmica?”. A prova prioriza a interpretaûÏûÈo e a aplicaûÏûÈo dos conceitos em situaûÏûçes reais, de acordo com as explanaûÏûçes acima. Fique atento, portanto, nas questûçes abaixo:
Vamos colocar a mûÈo na massa com exemplos prûÀticos de como o tema ûˋ cobrado.
Um dos problemas ambientais decorrentes da industrializaûÏûÈo ûˋ a poluiûÏûÈo atmosfûˋrica. A queima de carvûÈo mineral, por exemplo, libera para a atmosfera û°xidos de enxofre, que podem ser precursores da chuva ûÀcida. A reaûÏûÈo de combustûÈo completa do enxofre ûˋ representada pela equaûÏûÈo:
S(s) + Oã(g) ã SOã(g) öH = -297 kJ/mol de S(s)
Com base nessa equaûÏûÈo, ûˋ correto afirmar que a reaûÏûÈo ûˋ:
a) Endotûˋrmica, pois ocorre a formaûÏûÈo de SOã(g).
b) Exotûˋrmica, pois hûÀ liberaûÏûÈo de calor.
c) Endotûˋrmica, pois hûÀ consumo de Oã(g).
d) Exotûˋrmica, pois hûÀ diminuiûÏûÈo de temperatura.
e) Endotûˋrmica, pois hûÀ produûÏûÈo de um poluente.
ResoluûÏûÈo:
O enunciado fornece o valor de öH = -297 kJ/mol. Pela teoria, um öHô negativoô indica uma reaûÏûÈoô exotûˋrmica, ou seja, queô libera calor. Por consequûˆncia, a alternativa correta ûˋ a letraô B. Note que as demais alternativas usam informaûÏûçes irrelevantes ou incorretas, justamente para confundir.
Dadas as equaûÏûçes termoquûÙmicas:
I. C(grafita) + Oã(g) ã COã(g) öH = -394 kJ/mol
II. CO(g) + 1/2 Oã(g) ã COã(g) öH = -283 kJ/mol
Qual o valor de öH para a formaûÏûÈo do CO(g) a partir de C(grafita) e Oã(g)?
C(grafita) + 1/2 Oã(g) ã CO(g) öH = ?
ResoluûÏûÈo:
Como vimos, para dominar a TermoquûÙmica ûˋ importante saber interpretar grûÀficos para identificar o caminho de uma reaûÏûÈo de forma segura.
Dominar a Lei de Hess ûˋ fundamental para a resoluûÏûÈo de exercûÙcios de termoquûÙmica. Tambûˋm se aconselha a associaûÏûÈo desses fenûÇmenos com o dia a dia para compreender se determinada reaûÏûÈo ûˋ exotûˋrmica ou endotûˋrmica.
Por fim, pratica cûÀlculos com öH, pois sûÈo a chave para se sair bem nos exercûÙcios.
Agora, se vocûˆ de fato quer um plano de estudos estruturado para o Enem que te guie por todos esses tû°picos?ô Baixe gratuitamente o Enem Anatomy do Professor Ferretto, um material que disseca a prova e mostra o caminho das pedras para sua aprovaûÏûÈo.
Entender a teoria ûˋ fundamental, mas a aprovaûÏûÈo vem com a prûÀtica orientada. Muitos estudantes sabem “o que ûˋ termoquûÙmica” na teoria, mas travam na hora de resolver as questûçes, especialmente as que envolvemô como calcular o öHô usando aô Lei de Hess.
û aûÙ que oô Curso Professor Ferrettoô faz toda a diferenûÏa. Nossa metodologia ûˋ focada em:
Se vocûˆ quer transformar aô TermoquûÙmicaô de um ponto fraco em um dos seus maiores trunfos na prova de QuûÙmica, precisa conhecer nossa plataforma.
Comece sua jornada para a aprovaûÏûÈo acessando nosso curso gratuito aqui!
Aô TermoquûÙmicaô ûˋ, sem dû¤vida, um tema de altûÙssimo rendimento para suas provas. Ela ûˋ frequente, previsûÙvel e, quando bem compreendida, garante pontos preciosos. Dominar os conceitos deô reaûÏûçes endotûˋrmicas e exotûˋrmicas, saber trabalhar com aô variaûÏûÈo de entalpia (öH)ô e, principalmente, vencer os desafios daô Lei de Hess sûÈo passos essenciais para o sucesso. Utilize as dicas de estudo e os recursos recomendados, pratique com muitos exercûÙcios de termoquûÙmica e chegue no dia da prova com a confianûÏa de quem domina a energia das reaûÏûçes quûÙmicas. Sua aprovaûÏûÈo estûÀ mais perto do que vocûˆ imagina. Atûˋ mais!
Mas antes, confira a nova plataforma Pro e se prepare para Enem e vestibulares com o Professor Ferretto!

