
Assuntos de quĂmica que mais caem no Enem estĂŁo entre as principais dĂșvidas de quem estuda para a prova de...
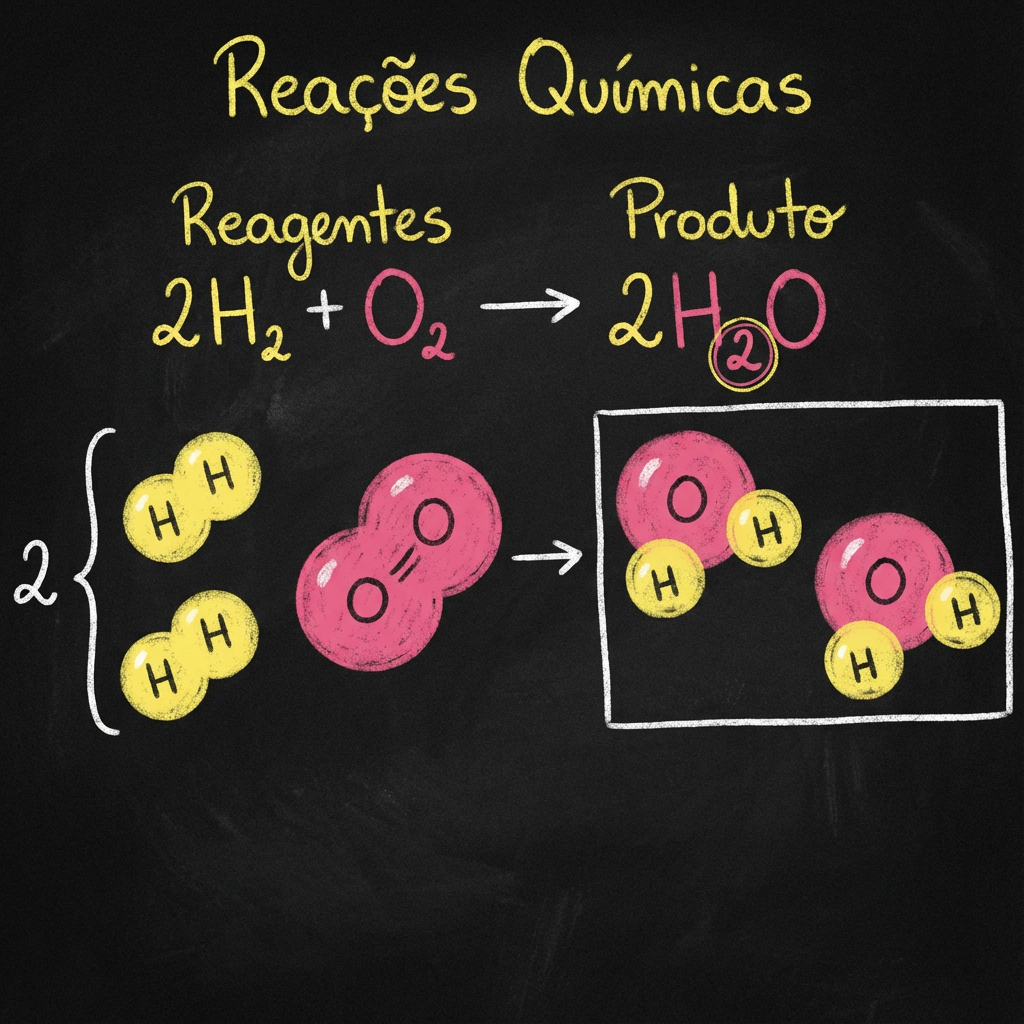
O post explora o conceito de reaçÔes quĂmicas, abordando a natureza das reaçÔes, suas caracterĂsticas principais como a conservação das massas entre reagentes e produto e como sĂŁo aplicadas na vida cotidiana e em exames como o ENEM. As reaçÔes quĂmicas sĂŁo definidas como processos onde os reagentes se transformam em novos produtos. Principais tipos de reaçÔes como sĂntese, decomposição, simples troca, dupla troca e combustĂŁo sĂŁo explicados com exemplos prĂĄticos. AlĂ©m disso, discute-se a importĂąncia de fatores que influenciam a velocidade das reaçÔes e o cĂĄlculo da variação de entalpia (âH). A importĂąncia do balanceamento de equaçÔes e ocasiĂ”es cotidianas onde ocorrem reaçÔes quĂmicas sĂŁo detalhadas. Por fim, o texto destaca a relevĂąncia do aprendizado desse tema para o ENEM e vestibulares, oferecendo dicas de estudo e mencionando mĂ©todos eficazes para dominar o assunto com o auxĂlio do Professor Ferretto.
OlĂĄ, pessoal! Hoje o objetivo Ă© desmistificar o conceito de reaçÔes quĂmicas. Iremos responder perguntas como: Quais sĂŁo os tipos de reaçÔes quĂmicas? Como balancear uma equação? O que Ă© entalpia (âH)? e, como esse tema cai no ENEM e em vestibulares?
Para começar, imagine-se fazendo um bolo, acendendo o fogĂŁo ou simplesmente respirando. Pode nĂŁo parecer, mas em todos esses momentos, uma força invisĂvel, porĂ©m fundamental, estĂĄ em ação, isto Ă©, as reaçÔes quĂmicas!
Assim, poder-se-ia dizer que as reaçÔes quĂmicas sĂŁo a linguagem universal da matĂ©ria, os processos pelos quais as substĂąncias se transformam. AtravĂ©s dessa transformação, surgem substĂąncias que por vezes apresentam caracterĂsticas muito diversas das que as criou.
Tem isso em conta, falaremos das caracterĂsticas e dos diferentes tipos de reaçÔes quĂmicas e do que as provoca. TambĂ©m veremos equaçÔes de reaçÔes quĂmicas e como o tema Ă© cobrado nas provas para ingresso nas universidades com exemplos prĂĄticos e exercĂcios resolvidos.
Em sua essĂȘncia, uma reação quĂmica é um processo em que uma ou mais substĂąncias â os reagentes â se transformam em uma ou mais substĂąncias novas â os produtos. Durante essa transformação, os ĂĄtomos sĂŁo rearranjados, mas nenhum ĂĄtomo Ă© criado ou destruĂdo â este Ă© o princĂpio da Conservação da Massa, estabelecido por Lavoisier.
Lembre-se, portanto, que o ĂĄtomo Ă© uma fração de matĂ©ria praticamente indestrutĂvel. Os ĂĄtomos sĂŁo forjados no nĂșcleo de estrelas. JĂĄ o rearranjo e combinaçÔes diferentes com outros ĂĄtomos Ă© o que cria as substĂąncias, as âcoisasâ que compĂ”em o nosso mundo. Esse rearranjo tem algumas caracterĂsticas, como veremos a seguir.
Como visto acima, as reaçÔes quĂmicas produzem novas substĂąncias a partir dos reagentes. As reaçÔes quĂmicas, portanto, alteram a prĂłpria realidade.Nas plantas, por exemplo, a glicose Ă© formada a partir do gĂĄs carbĂŽnico (CO2) e da ĂĄgua (H2O. AlĂ©m da glicose, essa reação libera gĂĄs oxigĂȘnio (O2), que depois aproveitamos em nossas cĂ©lulas a partir da respiração. De se ver que as reaçÔes quĂmicas sĂŁo a dança da quĂmica que cria a realidade fantĂĄstica que nos cerca. Abaixo as principais caracterĂsticas de uma reação quĂmica.
Para que os reagentes se transformem em produtos, é necessårio vencer uma barreira de energia chamada energia de ativação. Isso pode ser feito por:
Se vocĂȘ parar para pensar, verĂĄ que as reaçÔes quĂmicas sĂŁo os motores da existĂȘncia, pois, como vimos acima, sĂŁo elas que criam as coisas que nos cercam. A reaçÔes quĂmicas, portanto, sĂŁo responsĂĄveis por:
Agora que temos claro o que Ă© uma reação quĂmica, vamos Ă classificação das reaçÔes quĂmicas. Por que isso Ă© importante? Porque nos ajuda a prever os produtos e entender o comportamento da matĂ©ria. Vamos aos principais tipos, com exemplos de reaçÔes quĂmicas do cotidiano e das provas.
Ă a reação onde duas ou mais substĂąncias se combinam para formar um Ășnico composto, mais complexo.
ReaçÔes de sĂntese ou adição costumam aparecer em questĂ”es sobre corrosĂŁo e formação de Ăłxidos.

Oxidação do ferro – ferrugem.
Como vocĂȘ provavelmente jĂĄ deduziu, Ă© o processo inverso da sĂntese. Um composto se quebra em duas ou mais substĂąncias mais simples. Geralmente requer fornecimento de energia (calor, luz, eletricidade).
A eletrĂłlise da ĂĄgua ocorre a partir da passagem de corrente elĂ©trica que decompĂ”e a ĂĄgua em gĂĄs hidrogĂȘnio e gĂĄs oxigĂȘnio.
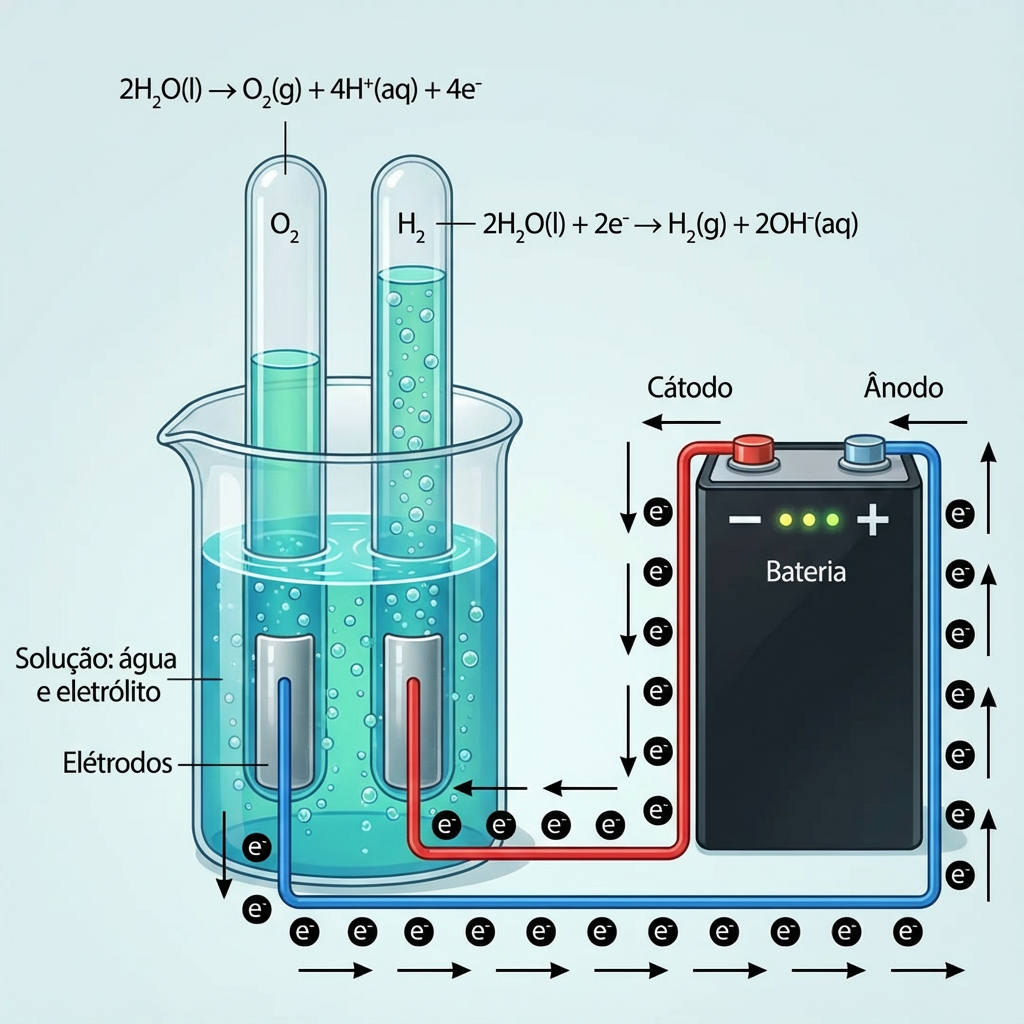
EletrĂłlise – separação do hidrogĂȘnio e do oxigĂȘnio da ĂĄgua.
Nesta reação, uma substùncia simples (um elemento livre) reage com um composto, deslocando um de seus elementos e ocupando o seu lugar.
Acontece quando dois compostos reagem entre si, trocando seus elementos ou radicais e formando dois novos compostos.
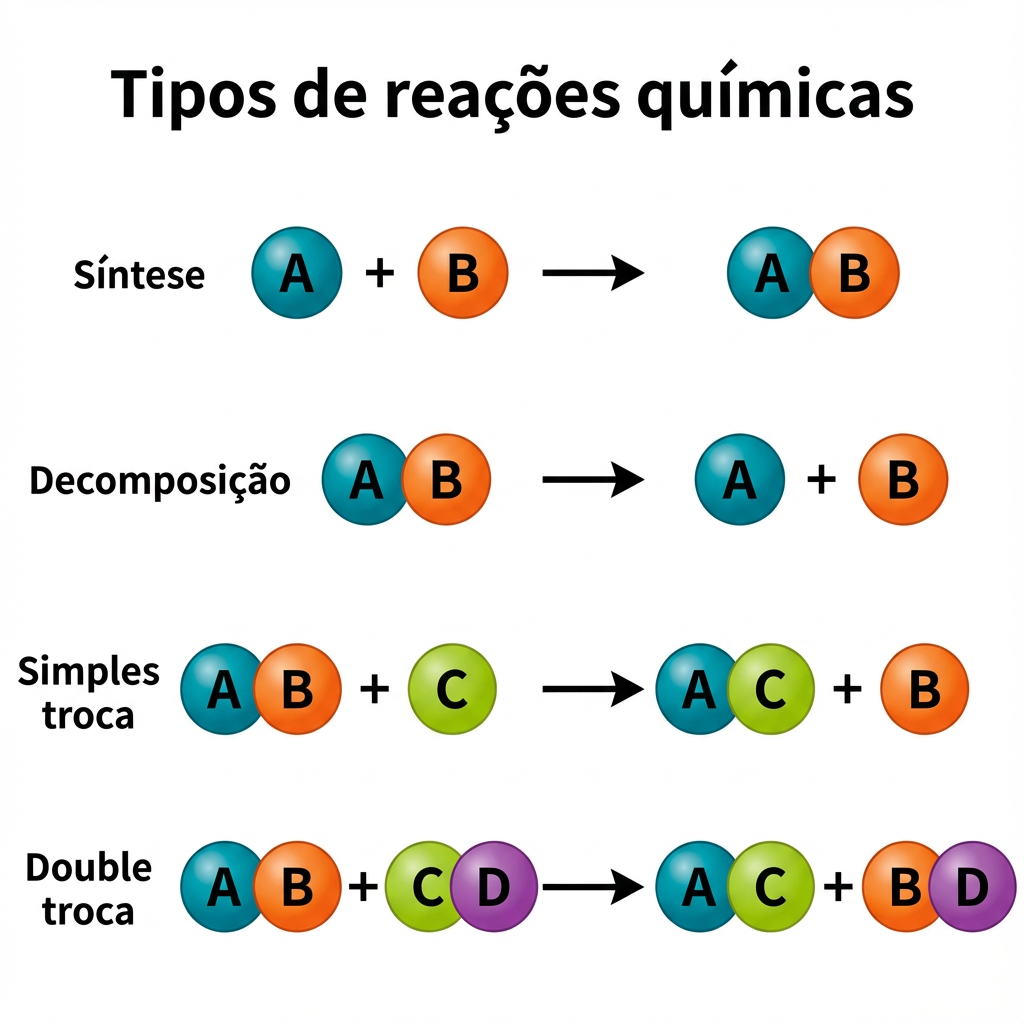
Tipos de reaçÔes quĂmicas.
Ă uma reação rĂĄpida de uma substĂąncia (combustĂvel) com o gĂĄs oxigĂȘnio (comburente), liberando uma grande quantidade de energia na forma de calor e luz. Ă sempre exotĂ©rmica.
Importante lembrar que as reaçÔes quĂmicas costumam ser tratadas como orgĂąnicas e inorgĂąnicas. A diferença essencial Ă© a presença ou nĂŁo de carbono. Nas reaçÔes orgĂąnicas hĂĄ sempre a presença de carbono.
Aproveite para assistir o vĂdeo abaixo do Professor Michel sobre reaçÔes quĂmicas.
<https://www.youtube.com/watch?v=-tUrBm4Dfbw>
O âH (Variação de Entalpia) indica o balanço energĂ©tico de uma reação quĂmica. Ă a diferença entre a energia dos produtos e a energia dos reagentes.
Para calcular a diferença de energia entre produtos e reagentes, isto Ă©, a variação da entalpia – âH, hĂĄ duas formas principais cobradas no ENEM ou nos vestibulares, conforme consta abaixo.
Ficou um pouco confuso? NĂŁo se preocupe! VocĂȘ pode ver informaçÔes mais detalhadas sobre âH e Lei de Hess e equalização de equaçÔes quĂmicas no artigo TermoquĂmica para dominar o tema.
A velocidade e a extensĂŁo de uma reação quĂmica nĂŁo sĂŁo fixas. HĂĄ vĂĄrios fatores, portanto, que sobre elas tĂȘm influĂȘncia:
A Lei da conservação em ação
Antes de qualquer cĂĄlculo (estequiometria, âH), a equação quĂmica deve estar balanceada. O nĂșmero de ĂĄtomos de cada elemento nos reagentes deve ser igual ao nĂșmero nos produtos.
Entender reaçÔes quĂmicas é entender o mundo ao seu redor. Veja algumas aplicaçÔes:

A fermentação Ă© uma reação quĂmica.
A essa altura, vocĂȘ provavelmente jĂĄ se deu conta de quĂŁo fantĂĄstico o nosso universo Ă©. JĂĄ imaginou se todos os elementos quĂmicos fossem energeticamente estĂĄveis como os gases nobres? O mundo seria um lugar estĂĄtico e sem graça, a vida sequer existiria.
Ă curioso pensar que, embora a natureza sempre busque o equilĂbrio energĂ©tico, a maior parte dos elementos quĂmicos justamente foi criada energeticamente desequilibrada. HĂĄ elementos com falta de energia, outros com excesso. O incrĂvel Ă© que sĂŁo justamente essas âimperfeiçÔesâ, esse desequilĂbrio energĂ©tico que torna possĂvel o mundo fantĂĄstico que nos cerca. As reaçÔes quĂmicas sĂŁo o palco em que se desenrola a prĂłpria vida.
ReaçÔes quĂmicas Ă© um tema sempre cobrado nas provas e pode aparecer de diferentes formas como:
Vamos analisar a reação: Zn(s) + CuÂČâș(aq) â ZnÂČâș(aq) + Cu(s)
Em primeiro lugar, determinar o Nox de cada elemento.
Na sequĂȘncia, identificar quem oxida e quem reduz.
Por Ășltimo, identificar os agentes.
Resumo da transferĂȘncia:
Zn ââââ ZnÂČâș + 2 eâ»Â (Oxidação)
CuÂČâș + 2 eâ» ââââ Cu (Redução)
(ENEM) O ferro Ă© encontrado na natureza na forma de seus minĂ©rios, como a hematita (FeâOâ). A obtenção do ferro metĂĄlico a partir da hematita envolve a sua redução com carvĂŁo coque (C) em altos-fornos, representada pela equação nĂŁo balanceada:
FeâOâ + C â Fe + COâ
Considerando que o rendimento do processo Ă© de 100%, qual a massa aproximada de carvĂŁo coque, em toneladas, necessĂĄria para produzir 1 tonelada de ferro metĂĄlico?
(Dados: Massas molares em g/mol: C = 12; O = 16; Fe = 56)
a) 0,16
b) 0,32
c) 0,48
d) 0,64
e) 0,80
Resolução råpida:
Dicas rĂĄpidas de estudo:

Realizando uma prova.
Entender a teoria é fundamental, mas saber aplicå-la sob a pressão de uma prova é outro desafio. Muitos estudantes travam na hora de identificar o tipo de reação, balancear equaçÔes complexas ou aplicar a Lei de Hess. à aà que a metodologia certa faz toda a diferença.
O Professor Ferretto Ă© um especialista em descomplicar a QuĂmica para vestibulares e ENEM. Seu mĂ©todo Ă© focado em:
Se vocĂȘ quer transformar seu estudo de reaçÔes quĂmicas e outros tĂłpicos de QuĂmica, a plataforma do Professor Ferretto oferece um caminho estruturado e eficiente.
Conheça a metodologia que jå ajudou milhares de estudantes a conquistarem sua aprovação.
E se vocĂȘ quer começar a estudar agora mesmo, de forma totalmente gratuita:
Acesse o Curso Gratuito do Professor Ferretto e tenha uma base sĂłlida em QuĂmica e todas as outras matĂ©rias.
As reaçÔes quĂmicas, como vimos, vĂŁo muito alĂ©m de uma lista de equaçÔes a decorar. Elas sĂŁo o prĂłprio motor de transformação da matĂ©ria e da prĂłpria possibilidade da existĂȘncia da vida. Para o estudante com o sonho de ingressar numa universidade, Ă© fundamental que domine a classificação das reaçÔes quĂmicas, os cĂĄlculos de energia, e os fatores que as influenciam. Isso Ă© a chave para decifrar inĂșmeras questĂ”es do ENEM e dos vestibulares. Seja curioso, use este conhecimento como base, pratique incansavelmente e busque os melhores recursos, como os oferecidos pelo Professor Ferretto, para transformar seu esforço em um resultado concreto: a sua aprovação.

