
Assuntos de química que mais caem no Enem estão entre as principais dúvidas de quem estuda para a prova de...

Os hidrocarbonetos são compostos químicos formados exclusivamente por átomos de carbono e hidrogênio. Este conteúdo é essencial na Química Orgânica, pois eles são a classe fundamental a partir da qual todos os compostos orgânicos são derivados. Eles são fontes primárias de energia e matéria-prima indispensáveis na indústria petroquímica, resultando em produtos como plásticos, borrachas e combustíveis. A correta nomenclatura dos hidrocarbonetos segue regras da IUPAC, permitindo a identificação clara e inequívoca de suas estruturas. A classificação é crucial, distinguindo-os por tipo de cadeia carbônica e tipo de ligação entre átomos de carbono. Hidrocarbonetos podem ser alcanos, alcenos ou alcinos, sendo diferenciados pela presença de ligações simples, duplas ou triplas, respectivamente. No ENEM e outros vestibulares, o tema é frequentemente cobrado em contextos de situações reais, como a relação entre combustão de hidrocarbonetos e impactos ambientais. Para dominar o tema, é necessário entender a lógica por trás das estruturas e nomeações, aplicar o conhecimento em diferentes contextos e resolver uma variedade de exercícios relacionados ao assunto.
“O que são hidrocarbonetos?” “Qual a importância deles para a Química Orgânica?” “Como esse tema cai no ENEM e em vestibulares?”
Dominar esse conteúdo significa compreender a lógica por trás da constituição e do comportamento das moléculas que formam o petróleo, o gás de cozinha, os plásticos e tantos outros compostos essenciais ao nosso dia a dia.
Este guia foi estruturado de forma clara e direta. Assim, ele não apenas explica o conceito, mas também mostra como estudar de maneira eficaz, integrando a metodologia comprovada do Professor Ferretto para sua jornada de aprendizado.
Continue a leitura e saiba mais.
Em sua definição mais pura, hidrocarbonetos são compostos químicos formados exclusivamente por átomos de carbono (C) e hidrogênio (H). Esta é, portanto, uma informação fundamental que você deve guardar.
Hidrocarbonetos são considerados a classe fundamental da Química Orgânica, logo, servindo como “esqueleto” a partir do qual todos os outros compostos orgânicos são derivados pela introdução de grupos funcionais (um conceito que exploraremos adiante).
Os hidrocarbonetos são a principal fonte de energia atualmente utilizada no planeta.
Quando submetidos a processos de combustão, os hidrocarbonetos liberam uma grande quantidade de energia, que é aproveitada para gerar eletricidade, movimentar veículos e aquecer ambientes.
Além disso, são a matéria-prima básica para a indústria petroquímica, dando origem a plásticos, borrachas, solventes, fibras têxteis e uma infinidade de outros produtos.
A classificação dos hidrocarbonetos é um passo crucial para entender seu comportamento. Eles são categorizados com base em dois critérios principais: o tipo de cadeia carbônica e o tipo de ligação entre os átomos de carbono.
A tabela abaixo resume as principais classificações:
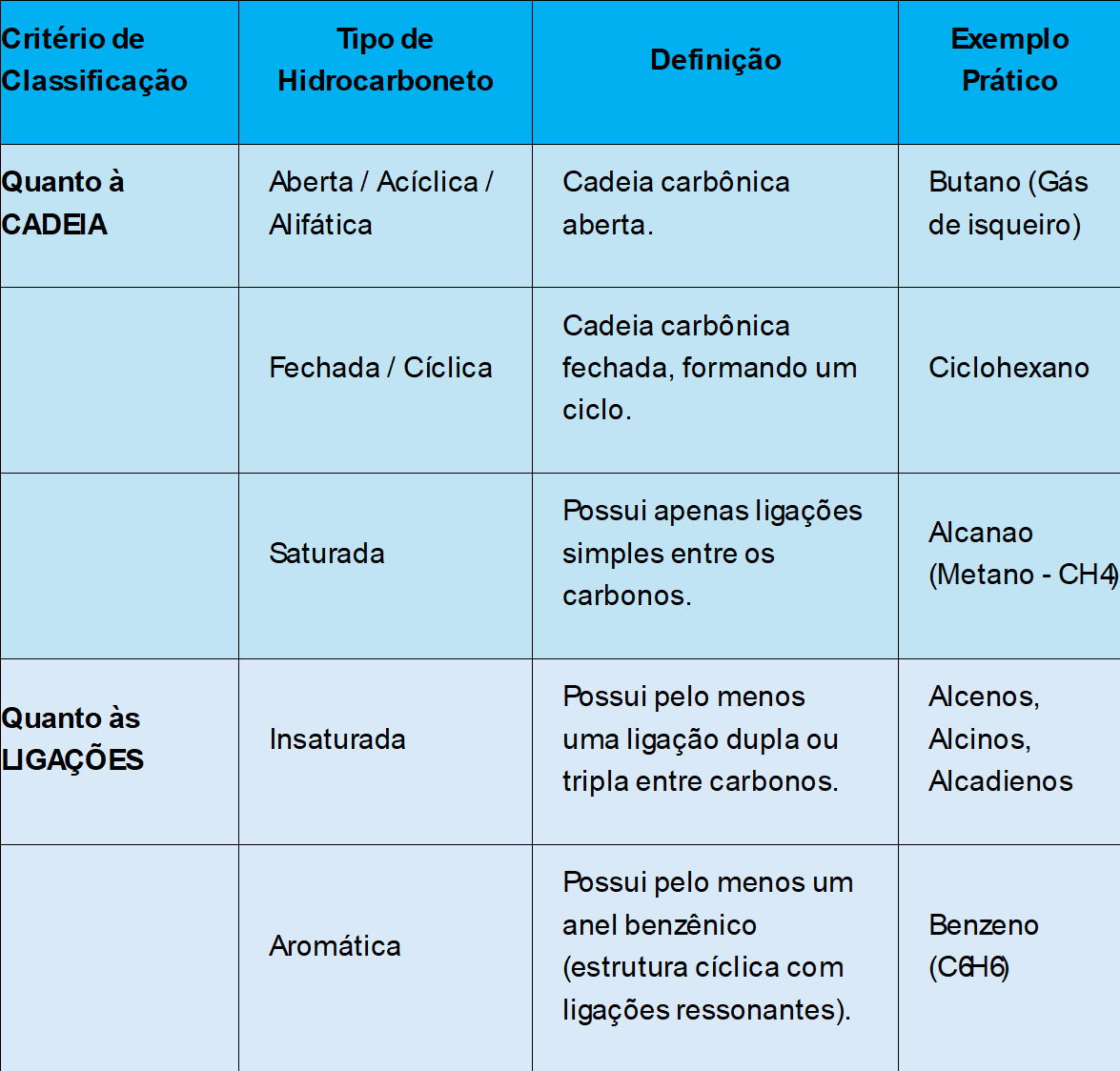
Dentre todos, o metano (CH₄) é considerado o hidrocarboneto mais simples e um dos mais importantes.
Ele é o principal componente do gás natural e frequentemente aparece em questões que abordam reações químicas de combustão e impacto ambiental.
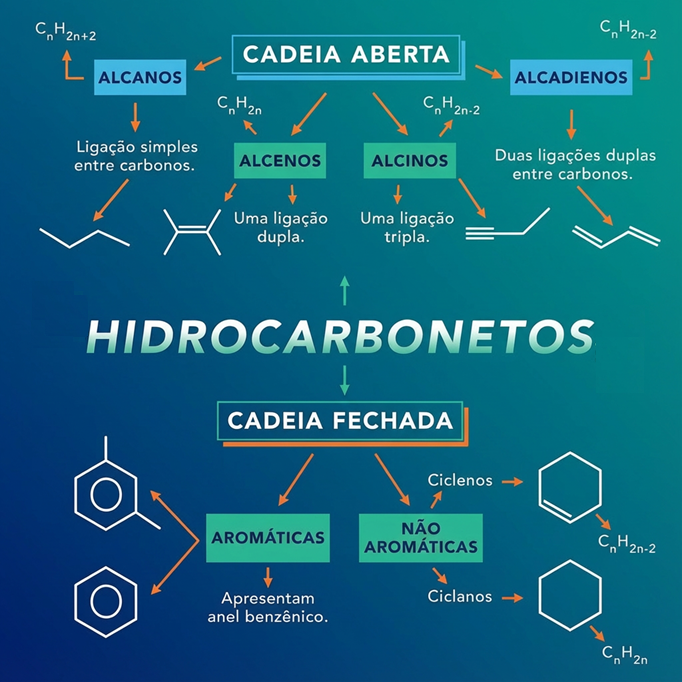
A nomenclatura dos hidrocarbonetos segue regras sistemáticas estabelecidas pela IUPAC (União Internacional da Química Pura e Aplicada). O objetivo é que o nome da molécula descreva sua estrutura de forma clara e inequívoca.
Aqui está um passo a passo claro e objetivo para nomear a maioria dos hidrocarbonetos comuns (alcanos, alcenos e alcinos).
Primeiro conheça os princípios básicos, veja abaixo:
Abaixo tabela completa para correta nomenclatura dos hidrocarbonetos. O prefixo a ser utilizado depende do número de carbonos. Já os infixos que indicam a presença de ligação simples, dupla ou tripla.
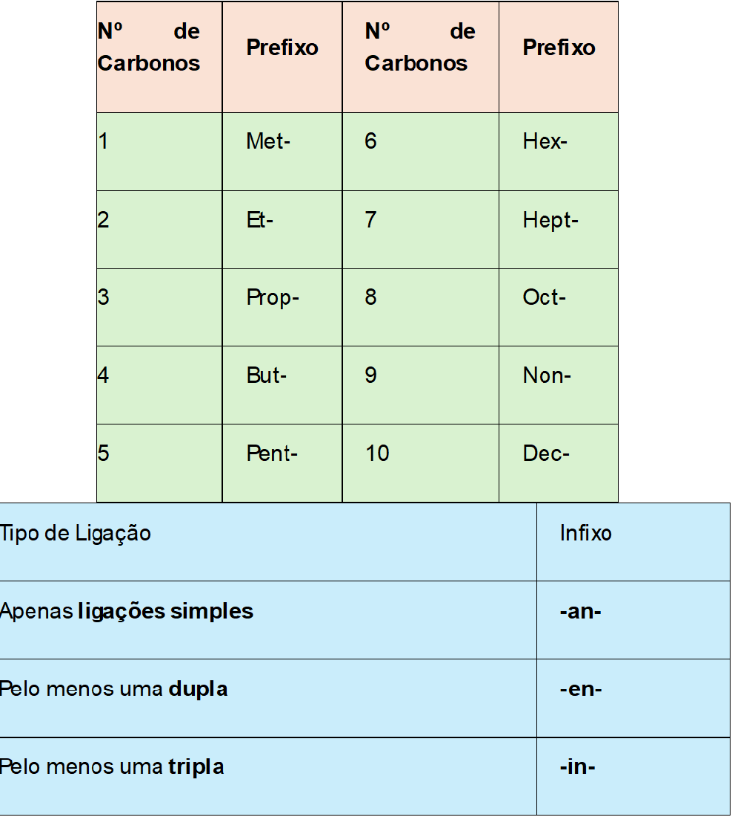
Veja o passo a passo para nomenclatura dos hidrocarbonetos abaixo. Para isso, vamos usar a seguinte molécula como exemplo:
CH₃ – CH = C (CH₃) – CH₂ – CH₃
Antes de continuar, lembre-se que a molécula acima também pode ser escrita como vemos abaixo. Fique atento, portanto, às diferentes formas de representação de uma molécula.
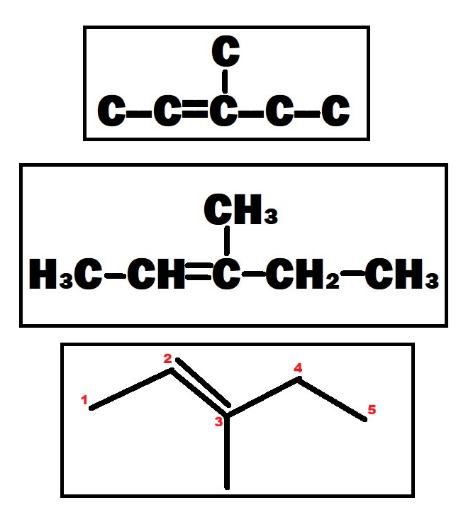
É a cadeia contínua mais longa de átomos de carbono. Se houver ligações duplas ou triplas, a cadeia principal DEVE contê-las.
No nosso exemplo a cadeia mais longa tem 5 carbonos. E ela contém a ligação dupla. Portanto, a cadeia principal é de 5 carbonos.
A numeração deve ser feita de forma que os carbonos das ligações duplas ou triplas recebam os menores números possíveis. Ignore ramificações neste momento.
No nosso exemplo:
São os grupos de carbono que saem da cadeia principal. Eles são nomeados trocando o sufixo -o do prefixo por -il ou -ila (Metil, Etil, Propil, etc.).
No nosso exemplo no carbono 3 da cadeia principal, há um grupo Metil (-CH₃).
A ordem do nome segue a estrutura:
[Nº da ramificação – nome da ramificação] [Nº da ligação – prefixo + infixo + sufixo]
Aqui se houver mais de uma ramificação, elas devem ser listadas em ordem alfabética (ignorando os prefixos de quantidade como di-, tri-).
No nosso exemplo:
Para que a questão da nomenclatura dos Hidrocarbonetos fique ainda mais clara, segue um vídeo do Professor Michel em que ele explica como fazer a correta nomenclatura dos Hidrocarbonetos ramificados.
https://www.youtube.com/watch?v=wwrUohgYw9w
Há casos em que a tabela de referência acima para nomenclatura dos hidrocarbonetos não é suficiente em alguns tipos de ligações, mas para isso há justamente as regras adicionais apresentadas abaixo.
Use os prefixos di-, tri-, etc., antes do infixo (-dien-, -triin-). A numeração deve priorizar as ligações múltiplas, mesmo que isso não dê o menor número para as ramificações. Por exemplo:
CH₂=CH-CH=CH₂ → Buta-1,3-dieno ou 1,3-butadieno
Adicione o prefixo Ciclo- antes do nome. Por exemplo: um anel de 6 carbonos com ligações simples é o ciclohexano. Um anel de 5 carbonos com uma dupla é o ciclopenteno.
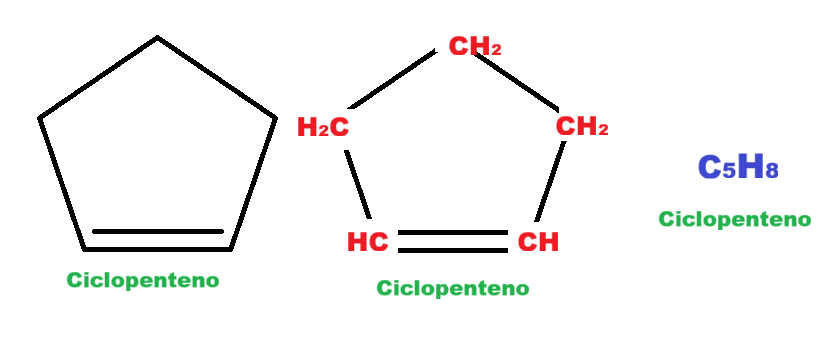
Se a molécula tiver ligação dupla e tripla, a numeração deve priorizar a que vier primeiro na cadeia. A prioridade para escolher a cadeia principal é:
Ligação dupla > ligação tripla > ramificações
Seguindo esses passos de forma sistemática, você conseguirá nomear a grande maioria dos hidrocarbonetos de cadeias simples. A prática é fundamental para consolidar o aprendizado
Exemplos:
As propriedades físicas e químicas dos hidrocarbonetos têm relação direta com a estrutura molecular e saturação da cadeia. As propriedades físicas estão mais diretamente ligadas ao mundo macro, como por exemplo, se o hidrocarboneto é sólido ou líquido, se é solúvel em água ou não. Já as propriedades químicas estão mais vinculadas ao mundo micro, pois têm relação mais direta com as formas de reações químicas envolvidas. Veja as propriedades dos hidrocarbonetos de forma mais detalhada abaixo.
A principal propriedade química dos hidrocarbonetos é a sua reatividade, especialmente por meio de reações químicas de combustão e substituição.
A classificação dos hidrocarbonetos é importante para que se tenha uma compreensão mais precisa de suas propriedades e, por consequência, os diferentes usos desses hidrocarbonetos. Como vimos acima, as diferentes propriedades e características de um hidrocarboneto provém da estrutura de sua molécula e do tipo de ligação entre os átomos de carbono, conforme veremos abaixo:

Como dito, os hidrocarbonetos são a base. Os grupos funcionais derivados de hidrocarbonetos são caracterizados por ligações entre átomos de carbono e outros elementos como oxigênio, nitrogênio ou halogênio.
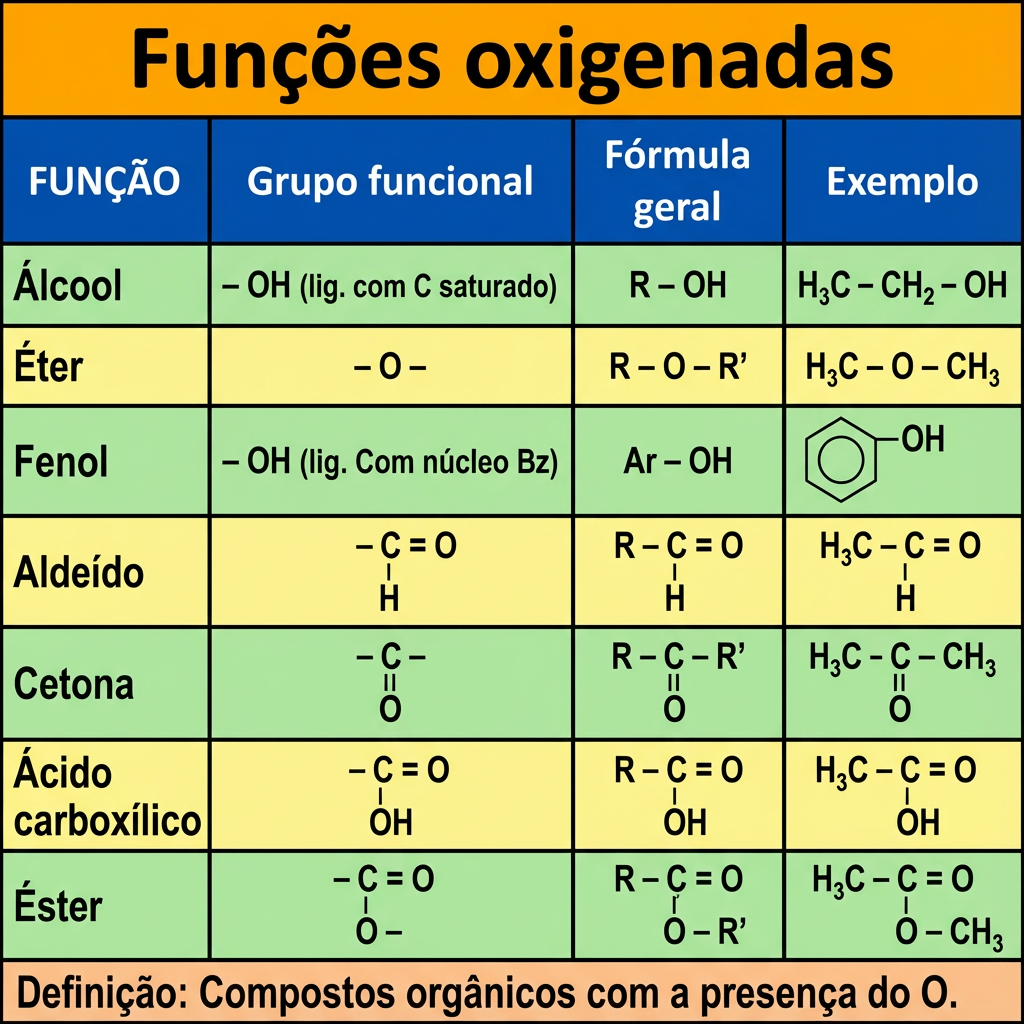
Esses grupos influenciam as propriedades químicas e físicas e químicas dos compostos orgânicos. Entre os grupos funcionais derivados o principal são os compostos oxigenados.
As funções oxigenadas, portanto, são grupos de compostos orgânicos que contêm átomos de oxigênio ligados à cadeia carbônica. Incluem álcoois, éteres, aldeídos, cetonas, ácidos carboxílicos e ésteres, como ilustrado no quadro abaixo.
Já os compostos funcionais nitrogenados contêm nitrogênio em sua estrutura, como as aminas. As aminas são compostos orgânicos nitrogenados derivados da amônia (NH3). As aminas podem ser utilizadas na fabricação de sabões, corantes e vulcanização de borrachas.

Os hidrocarbonetos estão presentes em nosso dia a dia nas mais diversas formas, condições e ambientes. Não fossem os hidrocarbonetos, seu carro a combustão não sairia da garagem, sua comida teria que ser inserida sem cozinhar.
A presença dos hidrocarbonetos é ubíqua, portanto! Isto é, estão por toda a parte. Reconhecê-los no cotidiano facilita a assimilação do conteúdo:

Este tema não é cobrado de forma isolada. As bancas, especialmente o ENEM, adoram contextualizar o conteúdo com situações-problema do mundo real. Fique atento a:
(Adaptado) O 2,2,4-trimetilpentano é um hidrocarboneto muito importante, pois é utilizado como padrão para determinar a octanagem da gasolina. Sua estrutura está representada abaixo.
CH3
|
CH3 – C – CH2 – CH – CH3
| |
CH3 CH3
Analisando a estrutura, pode-se afirmar que se trata de um:
a) Alceno de cadeia ramificada.
b) Alcino de cadeia linear.
c) Alcano de cadeia ramificada.
d) Cicloalcano de cadeia saturada.
e) Hidrocarboneto aromático.
Alternativa correta: C, pois o composto apresenta apenas ligações simples entre os átomos de carbono, caracterizando um alcano. Além disso, possui radicais metil (CH₃-) ligados à cadeia principal, configurando uma cadeia ramificada. A nomenclatura “2,2,4-trimetilpentano” já indica pelo sufixo -ano que é um alcano.
O limoneno é um hidrocarboneto natural presente na casca de frutas cítricas, como laranjas e limões, sendo responsável pelo aroma característico desses frutos. Sua estrutura molecular está representada abaixo:
(Imagem descrita: Uma estrutura cíclica com 6 carbonos, representando um anel. Do anel, sai um radical que forma uma segunda “ponta” com uma ligação dupla entre dois carbonos).
Fórmula Estrutural do Limoneno:
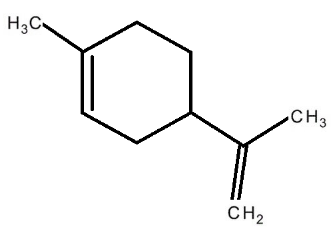
Com base na análise da estrutura do limoneno, é correto afirmar que se trata de um:
a) Alcano monocíclico saturado, de fórmula molecular C₁₀H₂₀.
b) Alceno acíclico, que apresenta isomeria geométrica cis-trans, de fórmula molecular C₁₀H₁₈.
c) Alceno bicíclico, que apresenta isomeria óptica, de fórmula molecular C₁₀H₁₆.
d) Alcano aromático, que apresenta carbonos com hibridização sp², de fórmula molecular C₁₀H₁₈.
Concluindo, a única alternativa que atende aos requisitos acima analisados é a letra c. A resposta correta, portanto, letra c.
A melhor forma de aprender, não raro, é uma questão bastante pessoal. Alguém prefere essas técnicas de estudo; já outro, aquelas. Para tentar atender a todos, segue algumas estratégias práticas de estudo que provavelmente lhe poderão ser úteis:
Se você busca um método estruturado, que realmente faça o conteúdo “clicar” na sua mente, o Professor Ferretto é uma referência consolidada no ensino de Química para vestibulares e ENEM. A didática característica do professor transforma temas complexos em explicações claras e objetivas.
O curso do Professor Ferretto, aborda o tema “Hidrocarbonetos” com profundidade e clareza, sempre conectando a teoria à resolução de exercícios típicos de prova. Você terá acesso a:
Se você quer um ponto de partida sólido e gratuito, recomendamos fortemente que se cadastre no Curso Gratuito do Professor Ferretto. É a oportunidade perfeita para experimentar a metodologia e turbinar seus estudos.
Quero acessar o Curso Gratuito agora!
Para aqueles que buscam a preparação mais completa e aprofundada, com todo o conteúdo programático, planos de estudo e suporte, explorem as opções do curso completo. É a maneira mais eficaz de garantir sua aprovação.
Descubra o plano ideal para sua aprovação!
Hidrocarbonetos estão na essência da Química Orgânica. Dominar o estudo dos hidrocarbonetos, portanto, é fundamental para o sucesso nessa área no ENEM e vestibulares.
Hidrocarbonetos, base de compostos como plásticos e combustíveis, é um tema que exige a compreensão de sua classificação, nomenclatura e propriedades, que variam com o tamanho da cadeia carbônica.
A abordagem das provas é contextualizada, frequentemente interligando conceitos como combustão e impacto ambiental a cálculos estequiométricos e análise de estruturas.
A estratégia de estudo, portanto, deve priorizar a resolução de exercícios de exames anteriores, focando na lógica da nomenclatura e na aplicação prática das reações, consolidando o conhecimento para uma interpretação eficaz das questões.
Bons estudos!

