
Assuntos de quГmica que mais caem no Enem estГЈo entre as principais dГєvidas de quem estuda para a prova de...

A Estequiometria Г© o cГЎlculo das quantidades de reagentes e produtos envolvidos em uma reação quГmica, sendo um tГіpico essencial em QuГmica, especialmente em exames como o ENEM. Ela se baseia em uma 'receita' precisa, similar ao preparo de um bolo, e depende do balanceamento correto das equações quГmicas para garantir que a Lei de Conservação das Massas, proposta por Lavoisier, seja respeitada. Esse conceito Г© aplicado em diversas situações cotidianas, como a combustГЈo de combustГvel e a digestГЈo dos alimentos. Para dominar a estequiometria, Г© necessГЎrio entender as relações quantitativas entre os elementos, balancear as equações, e conhecer as leis que regem esse cГЎlculo, como a Lei de Lavoisier, Proust e Dalton.
Imagine uma receita de bolo. Para fazer um bolo perfeito, vocГЄ precisa de quantidades especГficas de farinha, ovos, açúcar e manteiga. Se colocar ovos demais ou farinha de menos, o resultado serГЎ um desastre.В
A QuГmica, em sua essГЄncia, funciona de maneira muito similar. CadaВ reação quГmica — seja a combustГЈo da gasolina no motor do carro, a fotossГntese nas plantas ou a digestГЈo dos alimentos no seu corpo — segue uma “receita” precisa. Essa “receita” Г© o que chamamos deВ Estequiometria.
A Estequiometria Г© o cГЎlculo das quantidades de reagentes e produtos envolvidos em umaВ reação quГmica. Um tГіpico, portanto, frequente e importante na ГЎrea da quГmica. Por isso, para facilitar seus estudos, forneceremos a base necessГЎria e estratГ©gias para resolver os exercГcios em provas de admissГЈo para universidades.
Continue a leitura e confira!
Em termos tГ©cnicos, a Estequiometria (do gregoВ stoicheion, “elemento”, eВ metron, “medida”) Г© o ramo da QuГmica que estuda as relações quantitativas entre os elementos que formam os compostos (estequiometria de composição) e entre as substГўncias que participam de umaВ reação quГmicaВ (estequiometria de reação).В
Г‰ sobre esta Гєltima que nГіs vamos falar neste texto.
O ponto de partida para qualquer cГЎlculo estequiomГ©trico, por essa razГЈo, Г© umaВ reação quГmicaВ balanceada. O balanceamento, portanto, garante que a Lei de Conservação das Massas, proposta por Lavoisier, seja respeitada: “Na natureza, nada se cria, nada se perde, tudo se transforma”.В
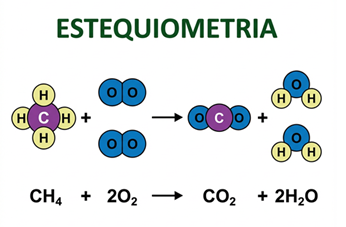
Isso significa que o número de átomos de cada elemento deve ser o mesmo nos reagentes e nos produtos. Para melhor visualizar, abaixo a ilustração da queima do metano (CH4) que produz gás carbônico (CO2) e água.
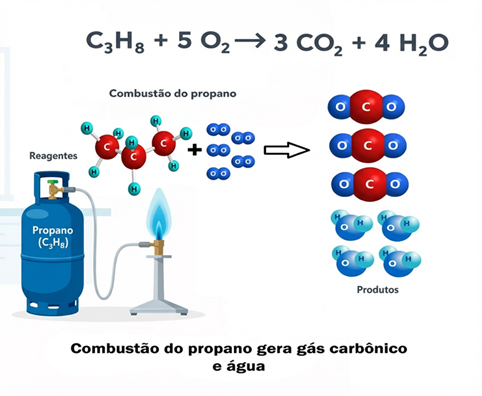
Considere a famosaВ reação quГmicaВ de combustГЈo do gГЎs propano (Cв‚ѓHв‚€), encontrado em botijГµes de gГЎs:
Cв‚ѓHв‚€ + Oв‚‚ в†’ COв‚‚ + Hв‚‚OВ (NГЈo balanceada)
Ao olharmos para essa equação, Г© possГvel verificar que a combustГЈo do gГЎs propano produz gГЎs carbГґnico e ГЎgua. HГЎ, no entanto, um problema: a equação quГmica NГѓO estГЎ balanceada.В
E como sabemos disso? FГЎcil! Note que na primeira parte da equação hГЎ 8 HidrogГЄnios, jГЎ na segunda, sГі dois. Observe, tambГ©m, que situação semelhante ocorre com o Carbono e o OxigГЄnio.В
Por conseguinte, se usГЎssemos essa equação, do jeito que estГЎ, para calcular a relação entre reagentes e produtos, chegarГamos a resultados absurdos, pois ela nГЈo obedece Г conservação da massa. A versГЈo balanceada correta Г©:
Cв‚ѓHв‚€ + 5 Oв‚‚ в†’ 3 COв‚‚ + 4 Hв‚‚O
Agora sim! Como você pode ver, temos, agora, a mesma quantidade de átomos de cada elemento em ambos os lados. Assim, essa equação nos diz que:
É a partir dessas proporções, os coeficientes estequiométricos (que na nossa equação em análise, são os números 1, 5, 3 e 4), que todos os cálculos são feitos a partir da equação balanceada.
Abaixo a ilustração da explicação feita acima sobre a queima do gás de cozinha.
Antes de partirmos para os cГЎlculos, Г© fundamental entender as leis que regem a Estequiometria. Elas sГЈo os pilares que garantem a precisГЈo dos resultados.
Em um sistema fechado, a massa total dos reagentes em uma reação quГmica Г© igual Г massa total dos produtos.В
Se 44g de propano reagem com 160g de oxigГЄnio, a soma das massas dos produtos (COв‚‚ e Hв‚‚O) serГЎ obrigatoriamente 204g, pois 160+44=204.
Um composto quГmico Г© sempre formado pelos mesmos elementos, combinados na mesma proporção em massa.В
Isto Г©, em uma reação quГmica, a proporção em massa das substГўncias que reagem e que sГЈo produzidas Г© sempre fixa. A ГЎgua (Hв‚‚O), por exemplo, sempre terГЎ a relação de 1g de H para 8g de O, independentemente de sua origem.
Quando dois elementos, ao se combinarem, formam mais de um composto, mantendo-se fixa a massa de um deles, a massa do outro varia numa relação de nГєmeros inteiros simples.В
E o que isso quer dizer? Г‰ dizer que a relação entre as massas dos elementos em diferentes compostos formados Г© sempre uma proporção fixa e que pode ser expressa numa razГЈo de nГєmeros inteiros simples. Г‰ o caso do CO (monГіxido de carbono) e do COв‚‚ (diГіxido de carbono).В
Para uma massa fixa de carbono, a massa de oxigГЄnio no COв‚‚ Г© o dobro da massa de oxigГЄnio no CO. Por quГЄ? Atente-se que a razГЈo de massa do OxigГЄnio para uma massa fixa de Carbono Г© 1:2.В
Isso significa que, para cada ГЎtomo de Carbono, o CO (monГіxido de carbono) tem um ГЎtomo de OxigГЄnio e o COв‚‚ tem 2 ГЎtomos de OxigГЄnio.В
Resolver um problema estequiomГ©trico Г© como seguir uma lista de verificações, um checklist. Desviar da ordem desse checklist Г© a principal causa de erros. Vamos ao roteiro infalГvel:
(QuestГЈo modelo Enem) O alumГnio Г© utilizado para a produção de tiras para fechamento de embalagens. Г‰ sabido que o alumГnio Г© produzido a partir da bauxita, que contГ©m Alв‚‚Oв‚ѓ. Quantos gramas de alumГnio sГЈo produzidos a partir de 5,1 kg de Alв‚‚Oв‚ѓ, conforme a reação:В
Alв‚‚Oв‚ѓ + C в†’ Al + COв‚‚?В
(Dados: Massas molares: Al=27 g/mol; O=16 g/mol; C=12 g/mol).
2 Alв‚‚Oв‚ѓ + 3 C в†’ 4 Al + 3 COв‚‚В
(Observe que a equação fornecida não estava balanceada, pois a quantidade de átomos de um e outro não correspondiam).
Detalhamento do balanceamento da equação:
Antes de seguir, vamos nos dedicar um pouco mais Г questГЈo do balanceamento da equação para que isso fique claro.В
Como vimos, a equação dada Г© Alв‚‚Oв‚ѓ + C в†’ Al + COв‚‚, mas facilmente se vГЄ que estГЎ desbalanceada. Vamos tentar balancear essa equação utilizando o mГ©todo de inspeção.В
Assim, definimos como coeficiente 1 para toda a equação, temos pois o seguinte:
1Alв‚‚Oв‚ѓ + 1C в†’ 1Al + 1COв‚‚
De imediato notamos que o Al nГЈo estГЎ equilibrado, pois na primeira parte da equação hГЎ 2 ГЎtomos de alumГnio. Vamos, portanto, multiplicar o alumГnio por 2 na parte dos produtos da equação. Temos daГ:
1Alв‚‚Oв‚ѓ + 1C в†’ 2Al + 1COв‚‚
Podemos ver agora que o AlumГnio estГЎ equilibrado, mas o OxigГЄnio nГЈo, pois hГЎ trГЄs ГЎtomos nos reagentes e apenas 1 no produto. Vamos, pois, multiplicar pelo coeficiente 2. Temos entГЈo:
2Alв‚‚Oв‚ѓ + 1C в†’ 2Al + 3COв‚‚В
(observe que nos reagentes estГЎ-se multiplicando 2 por 3 oxigГЄnios, como nos produtos jГЎ hГЎ dois oxigГЄnios, multiplico por 3 e tempos 6 oxigГЄnios em ambos os lados)
Vemos também que o C não está equilibrado, pois há 3 no lado dos produtos e apenas 1 no lado dos reagentes. Vamos multiplicar o C por 3 na primeira parte da equação, portanto:
2Alв‚‚Oв‚ѓ + 3C в†’ 2Al + 3COв‚‚
Finalmente podemos ver que o Гєnico que continua desequilibrado apГіs os ajustes Г© o Al, pois hГЎ 4 nos reagentes e apenas 2 nos produtos. Vamos multiplicar por 4 em vez de 2 no lado dos produtos, em consequГЄncia temos:
2Alв‚‚Oв‚ѓ + 3C в†’ 4Al + 3COв‚‚
Opa! Conseguimos balancear a equação! NГЈo Г© difГcil, sГі requer um pouco de atenção e seguir a sequГЄncia do mГ©todo de inspeção.
В Anotar dados
Pela equação balanceada, 2 mols de Al₂O₃ produzem 4 mols de Al. Simplificando, a relação é de 1 mol de Al₂O₃ para 2 mols de Al.
102 g de Alв‚‚Oв‚ѓ —— 54 g de Al
5100 g de Alв‚‚Oв‚ѓ —– X g de Al
X = (5100 * 54) / 102
X = 275400 / 102
X = 2700 g de Al
Resposta:В SГЈo produzidosВ 2700 gramasВ ouВ 2,7 kgВ de alumГnio.
A Estequiometria se manifesta de diferentes formas, dependendo do estado fГsico e da natureza das substГўncias envolvidas. Conhecer cada tipo Г© essencial para nГЈo se perder nas questГµes.
É o tipo mais comum, como no exemplo anterior. Envolve a conversão de massas entre reagentes e produtos, utilizando as massas molares. É pura aplicação das Leis de Proust e Lavoisier.
O mol Г© a unidade-base da QuГmica. Muitas vezes, os problemas jГЎ fornecem as quantidades em mol ou pedem o resultado nessa unidade. A relação Г© direta pelos coeficientes da equação.В
Ex: Na reação N₂ + 3H₂ → 2NH₃, 1 mol de N₂ reage com 3 mols de H₂ para produzir 2 mols de NH₃.
Para gases, em mesma pressГЈo e temperatura, volumes iguais contГЄm o mesmo nГєmero de mols (PrincГpio de Avogadro).В
Em Condições Normais de Temperatura e PressГЈo (CNTP: 0В°C e 1 atm), 1 mol de qualquer gГЎs ocupa aproximadamente 22,4 litros.В
Se um problema der o volume de um gГЎs, vocГЄ pode relacionГЎ-lo diretamente com a massa de um sГіlido, por exemplo.
Aqui, o conceito chave Г© aВ Concentração em mol/LВ (Molaridade). A relação Г©:В Concentração (mol/L) = nГєmero de mols / volume (L).В
Se um problema informa que você tem 500 mL de uma solução de HCl 2 mol/L, você pode calcular quantos mols de HCl estão presentes e relacionar com a massa de um metal que reage com esse ácido.
Porque Г© por meio delas que Г© possГvel calcular com precisГЈo as quantidades de reagentes e produtos nas reações quГmicas.В
Por consequГЄncia, essas relações sГЈo fundamentais para a prГЎtica da quГmica, pois Г© por meio das relações molares que Г© possГvel saber como as substГўncias interagem e antever o resultado de reações.В
Nesse contexto, Г© necessГЎrio saber responder Г s seguintes perguntas:
Mol Г© uma unidade de medida do Sistema Internacional de Unidades (SI), Г© a quantidade de matГ©ria que representa aproximadamente 6,022 x 10ВІВі entidades elementares como molГ©culas, ГЎtomos, Гons.
Massa molar, por sua vez, Г© a massa de um mol de substГўncia expressa em gramas por mol (g/mol).В
A massa molar Г© igual Г massa atГґmica dos elementos (daГ poder ser encontrada na Tabela PeriГіdica) ou molecular dos compostos. A massa molar da ГЎgua, por exemplo, Г© 18g/mol.
A relação entre o mol e a massa molar é dada pela equação n = m/MM onde:
Г‰, portanto, atravГ©s dessa fГіrmula que Г© possГvel calcular quantos mols de certa substГўncia estГЈo em uma amostra, dados seu peso e massa molar.
Para ilustrar, abaixo as relações molares expressas em diferentes unidades da amônia (2NH3) obtidas a partir de uma reação entre nitrogênio e hidrogênio.

A Estequiometria Г© tema regular na ГЎrea da QuГmica no Enem e nos vestibulares. Ela raramente aparece sozinha; geralmente estГЎ integrada a situações do cotidiano, problemas ambientais ou processos industriais.В
Os enunciados são longos e contextualizados, mas a resolução, no fundo, sempre segue o passo a passo que demonstramos.
As questГµes frequentemente testam:
Ficou com alguma dГєvida? Assista ao vГdeo a seguir do Professor Michel para ter uma compreensГЈo mais ampla dos pontos que se acabou de abordar.
В https://www.youtube.com/watch?v=gF-NVAVPaz0&list=PL4If1xXbEdeM-UyiJB5pznaBnbiPtMawZ
(Adaptado) O hidrГіxido de magnГ©sio, Mg(OH)в‚‚, Г© utilizado como antiГЎcido. Neutraliza o excesso de ГЎcido clorГdrico, HCl, no suco gГЎstrico, segundo a reação:
Mg(OH)в‚‚ + 2 HCl в†’ MgClв‚‚ + 2 Hв‚‚O
Se uma pessoa ingere 0,58 g de Mg(OH)в‚‚, o volume de suco gГЎstrico, em mL, neutralizado serГЎ de aproximadamente?
*Dados: Massas molares (g/mol): Mg=24, O=16, H=1; Cl=35,5. Concentração de HCl no suco gástrico = 0,1 mol/L.
Resolução:
Resposta:В O volume neutralizado serГЎ deВ 200 mLВ de suco gГЎstrico.
A combustГЈo completa da glicose, C6H12O6, Г© responsГЎvel pelo fornecimento de energia ao organismo humano. Na combustГЈo de 1,0 mol de glicose, o nГєmero de gramas de ГЎgua formado Г© igual a
Resolução:В
Como a combustão completa produz gás carbônico (CO₂) e água, vamos montar a equação.
Reação de combustГЈo da glicose:В
C6H12O6В + 6Oв‚‚ ——> 6COв‚‚В + 6Hв‚‚O
Como podemos ver pela equação acima, 1 mol de C6H12O6 forma 6 mols de H₂O.
Quantas gramas hГЎ em 6 mols de ГЎgua?
1 mol de Hв‚‚O ———– 18g
6 mols de Hв‚‚O ———– Xg
(6×18)/1=108
X = 108g – Alternativa correta “d”, portanto.
Para concluir, segue imagem ilustrativa da molГ©cula de glicose, objeto da questГЈo analisada.
Se vocГЄ chegou atГ© aqui e ainda sente que a Estequiometria Г© um desafio, saiba que vocГЄ nГЈo estГЎ sozinho. Г‰ um tema que exige prГЎtica, mГ©todo e uma didГЎtica que esteja sintonizada com o seu raciocГnio.В
Г‰ aГ que entra a plataforma doВ Professor Ferretto, uma das mais reconhecidas e eficazes para o aprendizado de Exatas no Brasil.
Os diferenciais do curso para o Enem e vestibulares do Professor Ferretto no ensino de QuГmica, e especificamente de Estequiometria, sГЈo:
Se seu objetivo Г© dominar aВ classificação das reações quГmicasВ e os cГЎlculos estequiomГ©tricos para gabaritar as questГµes do Enem, a metodologia do Professor Ferretto Г© o caminho mais estruturado e confiГЎvel.
Quer se tornar expert em QuГmica para o Enem? ConheГ§a a nossa plataforma e veja como descomplicar a QuГmica e outras matГ©rias. Cadastre-se gratuitamente para acessar conteГєdos exclusivos e comece hoje mesmo a sua preparação para o vestibular!
👉 Acesse o ENEM Anatomy aqui e potencialize seus estudos!
Está com o orçamento apertado? Não se preocupe! Também temos um curso gratuito para você começar a sua jornada rumo à aprovação. A qualidade Professor Ferretto ao alcance de todos.
рџЋ“ Comece agora com o Curso Gratuito do Professor Ferretto!
A Estequiometria Г©, sem dГєvida, a espinha dorsal dos cГЎlculos quГmicos. Longe de ser um bicho de sete cabeГ§as, ela Г© um conjunto de regras lГіgicas e previsГveis. DominГЎ-la significa desbloquear a capacidade de entender e prever o comportamento da matГ©ria em qualquerВ reação quГmica, desde as mais simples atГ© as mais complexas.
Em estequiometria, comece sempre pela equação balanceada, identifique as grandezas, use as relações molares e faГ§a as conversГµes com cuidado. Pratique incansavelmente todos osВ exemplos de reações quГmicasВ e tipos de relações (massa, mol, gases e soluções).В
E, se precisar de uma direção clara e um método comprovado, a plataforma do Professor Ferretto está à disposição para ser o seu guia. Com dedicação e a estratégia correta, a Estequiometria se tornará não uma pedra no seu sapato, mas uma das suas maiores armas para conquistar uma vaga na universidade dos seus sonhos.

