
Assuntos de quûÙmica que mais caem no Enem estûÈo entre as principais dû¤vidas de quem estuda para a prova de...

Este post parece ser um rascunho automûÀtico sem conteû¤do especûÙfico disponûÙvel. Em sites de blogs, como os de professores focados em preparar alunos para o ENEM, posts sûÈo frequentemente salvos como rascunhos automûÀticos quando estûÈo em desenvolvimento. Esta prûÀtica ajuda a garantir que as ideias e conteû¤dos sejam registrados e possam ser revisados antes da publicaûÏûÈo final.
Presente de forma consistente e interdisciplinar nas provas, o conhecimento sobreô ûÀcidos e bases ûˋ, pois, necessûÀrio para resolver questûçes sobre identificaûÏûÈo de propriedades, equilûÙbrio quûÙmico, funûÏûçes orgûÂnicas e fenûÇmenos do cotidiano.
Este artigo foi desenvolvido para que vocûˆ compreenda o que sûÈo ûÀcidos e bases e conheûÏa as diferentes teorias que os explicam. AprenderûÀ sobre o mûˋtodo de nomenclatura tanto de ûÀcidos quanto de bases.
Alûˋm disso, ao explorarmos os usos de ûÀcidos e bases no dia a dia, sua presenûÏa na quûÙmica orgûÂnica, bem como exemplos de questûçes com respectiva resoluûÏûÈo, vocûˆ construirûÀ uma base sû°lida para enfrentar questûçes do Enem e vestibulares com serenidade e confianûÏa.
Continue a leitura e confira!
A pergunta “o que sûÈo ûÀcidos e bases?” parece simples, mas a resposta evoluiu com o tempo. Diferentes cientistas propuseram teorias que ampliaram nossa compreensûÈo sobre essas substûÂncias, tornando o conceito mais abrangente e preciso.
Por conseguinte, ûˋ fundamental conhecer essa evoluûÏûÈo, pois cada teoria oferece uma lente diferente para analisar as reaûÏûçes quûÙmicas, e todas sûÈo passûÙveis de cobranûÏa.
As teorias que explicam os ûÀcidos e bases evoluûÙram com o tempo. Cada uma delas oferece uma visûÈo diferente e complementar do que sûÈo substûÂncias ûÀcidas ou bûÀsicas.
Essas teorias possibilitam uma compreensûÈo mais profunda sobre o comportamento quûÙmico dessas substûÂncias quando interagem com outras substûÂncias.
Por consequûˆncia, o domûÙnio desse conhecimento permite aos quûÙmicos predizer o que ocorre quando se mistura uma substûÂncia ûÀcida com uma bûÀsica, ou mesmo com uma outra substûÂncia. O que, por û°bvio, ûˋ muito û¤til na indû¤stria quûÙmica, bem como, para se entender fenûÇmenos do dia a dia.
Proposta pelo sueco Svante Arrhenius em 1887, esta foi a primeira teoria a definirô ûÀcidos e basesô de forma moderna e operacional.
Por quûˆ? Porque Arrhenius, a partir de experimentos com diferentes substûÂncias em soluûÏûÈo aquosa, verificou diferentes comportamentos, conseguindo, pois, diferenciar ûÀcidos e bases, conforme descrito abaixo.
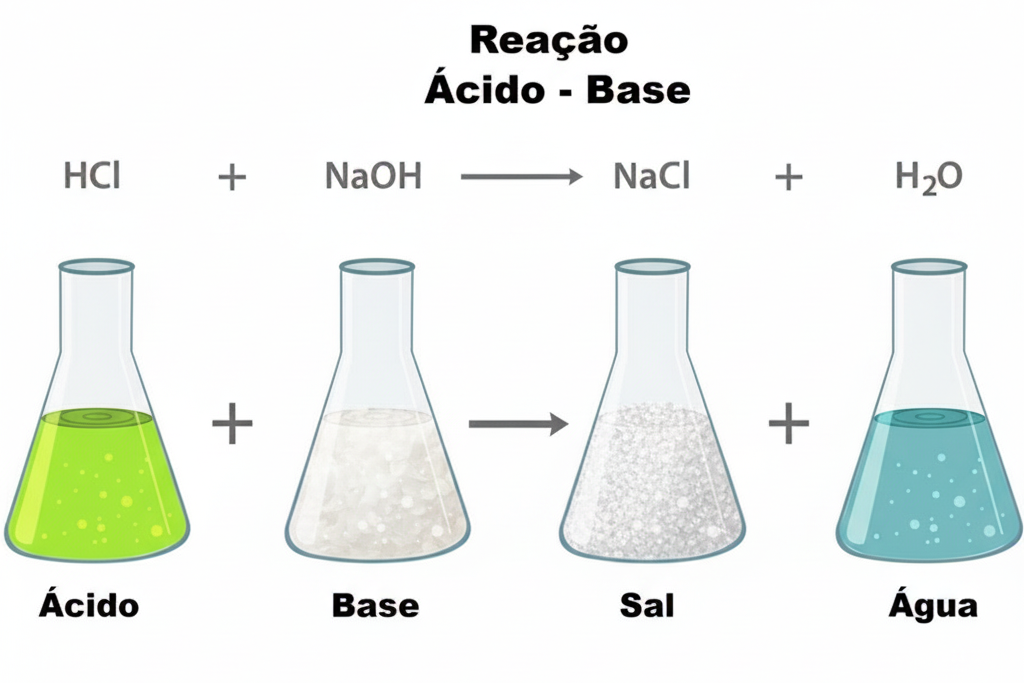
û toda substûÂncia que, em soluûÏûÈo aquosa, se ioniza liberandoô ûÙons Hã¤ô (prû°tons) como û¤nico cûÀtion. Exemplo: o HCl (ûÀcido clorûÙdrico) em ûÀgua: HCl(aq) ã Hã¤(aq) + Clã£(aq).
Aqui cabe uma rûÀpida observaûÏûÈo. Muitos podem se perguntar, por que prû°tons se um cûÀtion ûˋ um elemento que perde elûˋtrons e ûÂnion o que ganha elûˋtrons?
Importante notar que o hidrogûˆnio (H) sû° tem um prû°ton e um elûˋtron. Assim, quando o hidrogûˆnio perde seu û¤nico elûˋtron, sû° resta o prû°ton. Com carga positiva, obviamente.
û toda substûÂncia que, em soluûÏûÈo aquosa, se dissocia liberandoô ûÙons OHã£ô (hidroxila) como û¤nico ûÂnion. Exemplo: o NaOH (hidrû°xido de sû°dio) em ûÀgua:
NaOH(aq) ã Naã¤(aq) + OHã£(aq)
Atravûˋs de um olhar mais criterioso, deduz-se que a grande limitaûÏûÈo da teoria de Arrhenius estûÀ em seu meio. Como assim? Ora, pois, ela se restringe û s soluûÏûçes aquosas.
Alûˋm disso, nûÈo explica, por exemplo, por que uma substûÂncia como a amûÇnia (NHã) apresenta carûÀter bûÀsico sem possuir OH㣠em sua fû°rmula.
Dûˋcadas apû°s Arrhenius, em 1923, de forma independente, o dinamarquûˆs Johannes BrûÑnsted e o inglûˆs Thomas Lowry propuseram uma definiûÏûÈo mais geral, focada na transferûˆncia de prû°tons (Hã¤).
Essa teoria introduz o conceito fundamental deô par conjugado ûÀcido-base. O que quer dizer isso?
Em uma reaûÏûÈo, quando um ûÀcido doa um prû°ton, ele se transforma em sua base conjugada. Da mesma forma, quando uma base aceita um prû°ton, torna-se seu ûÀcido conjugado.
Um exemplo clûÀssico ûˋ a reaûÏûÈo entre o ûÀcido acûˋtico (vinagre) e a ûÀgua:
CHãCOOH + HãO ã CHãCOO㣠+ HãOã¤
Nesse caso, o CHãCOOH ûˋ o ûÀcido (doador de Hã¤), e a HãO atua como base (aceptora de Hã¤).
No sentido inverso, o ûÙon CHãCOO㣠ûˋ a base conjugada do ûÀcido acûˋtico, e o HãO㤠(ûÙon hidrûÇnio) ûˋ o ûÀcido conjugado da ûÀgua.
Como se pode notar, essa teoria amplia enormemente o escopo das substûÂncias consideradas bûÀsicas, incluindo a amûÇnia (NHã), que aceita um prû°ton para formar NHã㤠(ûÙon amûÇnio, ou cûÀtion amûÇnio).
Abaixo imagem da reaûÏûÈo entre um ûÀcido e uma base que tem como produtos o sal e a ûÀgua, duas substûÂncias neutras.
Tambûˋm em 1923, o americano Gilbert Lewis propûÇs uma definiûÏûÈo ainda mais abrangente, baseada no compartilhamento de pares de elûˋtrons, sem envolver necessariamente a transferûˆncia de prû°tons.
Por essa razûÈo, Lewis definiu ûÀcidos e bases, conforme segue:
Essa teoria ûˋ extremamente poderosa, especialmente emô quûÙmica orgûÂnica, onde muitas reaûÏûçes (como as de Friedel-Crafts) envolvem catalisadores ûÀcidos de Lewis, como o AlClã (cloreto de alumûÙnio), que aceita um par de elûˋtrons.
De se notar, que a teoria de Lewis engloba as definiûÏûçes anteriores: um ûÀcido de BrûÑnsted (doador de Hã¤) ûˋ um caso particular de ûÀcido de Lewis, pois o H㤠aceita o par de elûˋtrons doado pela base.
Saber nomear corretamente os compostos ûˋ essencial para interpretar questûçes e comunicar ideias de forma precisa.
NûÈo por menos, as regras de nomenclatura paraô ûÀcidos e basesô seguem convenûÏûçes especûÙficas, de acordo com as regras explicitadas abaixo.
Podem ser divididos em dois grandes grupos: hidrûÀcidos e oxiûÀcidos.
Os hidrûÀcidos (ûÀcidos sem oxigûˆnio) sûÈoô formados por hidrogûˆnio (H) + um elemento (geralmente nûÈo-metal). Por isso, a nomenclatura ûˋ:ô ûcido + [nome do elemento] + ûÙdrico.
Por exemplo: HCl – ûÀcido clorûÙdrico; HãS – ûÀcido sulfûÙdrico; HF – ûÀcido fluorûÙdrico.
JûÀ os oxiûÀcidos (ûÀcidos com oxigûˆnio), sûÈoô formados por hidrogûˆnio (H) + elemento + oxigûˆnio (O). Nesse caso, o sufixo depende do nox (nû¤mero de oxidaûÏûÈo) do elemento central. Por exemplo:
Resumindo:
NOX +7:ô Per–ico (Perclû°rico).
NOX +5 ou +6:ô –ico (NûÙtrico, Sulfû¤rico).
NOX +3 ou +4:ô –oso (Nitroso, Sulfuroso).
NOX +1 ou +2:ô Hipo–oso (Hipocloroso).ô
SûÈo compostos iûÇnicos formados por um cûÀtion (geralmente metûÀlico ou NHãã¤) e o ûÂnion OHã£. Nesse caso, a nomenclatura ûˋ:ô Hidrû°xido de [nome do cûÀtion]. Por exemplo:
Longe de serem conceitos abstratos, restritos aos laboratû°rios, osô ûÀcidos e basesô permeiam nossa rotina. Reconhecer suas aplicaûÏûçes e presenûÏa torna o aprendizado mais significativo e ajuda na contextualizaûÏûÈo, uma marca registrada do Enem.
Veja os exemplos de ûÀcidos e bases:
Na prûÀtica, existem formas experimentais simples de se identificar se uma substûÂncia ûˋ ûÀcida ou bûÀsica.
A mais comum ûˋ o uso deô indicadores ûÀcido-base, como a fenolftaleûÙna e o tornassol, que mudam de cor conforme o pH do meio. Oô papel de tornassol, por exemplo, fica vermelho em meio ûÀcido e azul em meio bûÀsico.
Outra forma ûˋ medir oô pHô (potencial hidrogeniûÇnico), uma escala que vai de 0 a 14 e quantifica a concentraûÏûÈo de ûÙons HãOã¤.
Uma maneira interessante para saber se algo ûˋ ûÀcido ou bûÀsico no dia a dia ûˋ utilizar suco de couve-roxa. Vocûˆ pode fazer esse experimento em sua casa mesmo.
Ao se acrescentar uma substûÂncia ûÀcida, o suco fica vermelho ou rosa. JûÀ para as bases, fica com tonalidade azul ou esverdeada.
Alûˋm disso, os ûÀcidos tûˆm sabor azedo, como limûÈo e vinagre. JûÀ as bases tûˆm sabor amargo como o bicarbonato de sû°dio e sensaûÏûÈo de que sûÈo escorregadios.
Em biologia, referimo-nos û sô quatro bases nitrogenadasô que compûçem o DNA: Adenina (A), Timina (T), Citosina (C) e Guanina (G).
Isto ûˋ, sûÈo compostos quûÙmicos com nitrogûˆnio que se unem para construir osô nucleotûÙdeos, as unidades fundamentais do DNA e RNA, classificadas como purinas (A, G) com dois anûˋis, e pirimidinas (T, C, e U no RNA) com um anel, pareando-se sempre A com T e C com G para formar a dupla hûˋlice do DNA.
Muito importante, por essa razûÈo, nûÈo confundir este conceito bioquûÙmico com o conceito quûÙmico de bases (hidrû°xidos) discutido aqui.
Os ûÀcidos podem ter diferentes utilizaûÏûçes e funûÏûçes. EstûÈo naturalmente presentes em nosso corpo como o ûÀcido desoxirribonucleico (DNA), o suco gûÀstrico em nosso estûÇmago.
ûcidos tambûˋm estûÈo naturalmente presentes em uma infinidade de frutas, como laranjas, limûÈo e ameixas. Abaixo alguns ûÀcidos com a respectiva fû°rmula quûÙmica:
Da mesma forma como os ûÀcidos, as bases tûˆm diferentes aplicaûÏûçes e usos. Tambûˋm estûÈo presentes naturalmente em nosso corpo, em frutas e cereais.
Seguem algumas bases tambûˋm com a respectiva fû°rmula quûÙmica:
As principais substûÂncias de natureza bûÀsica (alcalina) presentes naturalmente no corpo humano, em frutas e em cereais sûÈo osô sais minerais, especialmente oô potûÀssio,ô cûÀlcio,ô sû°dio e magnûˋsio. Elas atuam no equilûÙbrio ûÀcido-base do organismo
Note-se, pois, que o organismo mantûˋm um equilûÙbrio ûÀcido-base rigoroso (homeostase) por meio de sistemas tampûÈo, que envolvem:
Para ajudar na compreensûÈo do tema, nûÈo deixe de assistir o vûÙdeo preparado pelo Prof. Michel sobre ûÀcidos e bases. https://www.youtube.com/watch?v=7TvKQrv0ZQI
O temaô ûÀcidos e basesô ûˋ um dos mais queridos pelas bancas examinadoras, e por boas razûçes.
Ele permite avaliar competûˆncias que vûÈo desde a memorizaûÏûÈo de conceitos bûÀsicos atûˋ a aplicaûÏûÈo de raciocûÙnio lû°gico em situaûÏûçes-problema complexas.
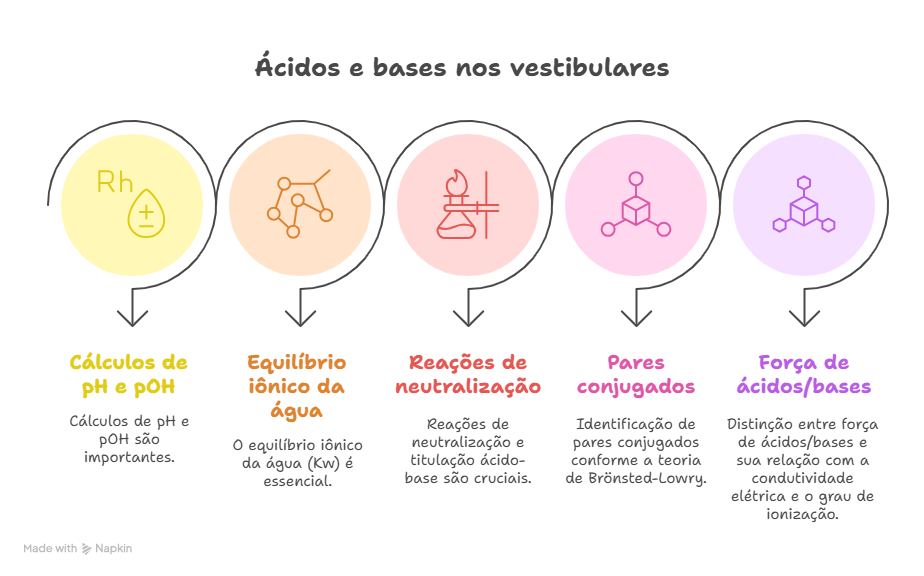
JûÀ nos vestibulares tradicionaisô (como Fuvest, Unicamp, Unesp), alûˋm da contextualizaûÏûÈo, hûÀ uma cobranûÏa maisô conceitual e matemûÀtica, de acordo com o quadro ilustrativo a seguir.
Portanto, dominarô ûÀcidos e basesô nûÈo se resume a decorar fû°rmulas; exige compreender as teorias, saber relacionar com fenûÇmenos do mundo real e aplicar o conhecimento em cûÀlculos precisos.
Vamos praticar com questûçes no estilo Enem para consolidar o conhecimento.
QuestûÈo 1 (estilo Enem – contextualizada)
O refrigerante, uma bebida amplamente consumida, possui em sua composiûÏûÈo o ûÀcido fosfû°rico (HãPOã), responsûÀvel por realûÏar o sabor e tambûˋm por evitar a proliferaûÏûÈo de micro-organismos. O consumo excessivo de bebidas com esse ûÀcido tem sido relacionado a problemas de saû¤de, como a osteoporose, pois interfere no metabolismo do cûÀlcio. Em relaûÏûÈo ao ûÀcido fosfû°rico, ûˋ correto afirmar que:
a) û um ûÀcido fraco, conforme a teoria de Arrhenius, pois se ioniza parcialmente em ûÀgua.
b) Em soluûÏûÈo aquosa, conduz corrente elûˋtrica devido û formaûÏûÈo de ûÙons H㤠e POãô°ã£.
c) De acordo com BrûÑnsted-Lowry, atua como uma base, pois pode receber prû°tons.
d) û um hidrûÀcido, pois em sua fû°rmula nûÈo hûÀ presenûÏa de oxigûˆnio.
e) Sua presenûÏa em refrigerantes torna o pH dessas bebidas bûÀsico (pH > 7).
ResoluûÏûÈo comentada:
QuestûÈo 2 (estilo vestibular – conceitual/cûÀlculo)
(Adaptada UNESP) Uma soluûÏûÈo de hidrû°xido de sû°dio (NaOH) de concentraûÏûÈo 0,1 mol/L foi utilizada para titular 20 mL de uma soluûÏûÈo de ûÀcido clorûÙdrico (HCl) de concentraûÏûÈo desconhecida. Sabendo que foram gastos 25 mL da soluûÏûÈo de NaOH para atingir o ponto de equivalûˆncia, calcule a concentraûÏûÈo, em mol/L, da soluûÏûÈo de ûÀcido clorûÙdrico.
ResoluûÏûÈo comentada:
Este ûˋ um clûÀssico problema de titulaûÏûÈo ûÀcido-base, envolvendo cûÀlculo estequiomûˋtrico (nûÈo deixe, pois, de conferir nosso artigo sobre estequiometria)
Resposta:ô A concentraûÏûÈo da soluûÏûÈo de ûÀcido clorûÙdrico ûˋ 0,125 mol/L.
Agora que vocûˆ jûÀ percebeu a amplitude e a importûÂncia do tema, ûˋ natural querer se aprofundar ainda mais. A revisûÈo sistemûÀtica e a prûÀtica orientada sûÈo as chaves para a consolidaûÏûÈo do aprendizado. Para isso, contar com um mûˋtodo estruturado faz toda a diferenûÏa.
Oô Mûˋtodo Ferrettoô ûˋ reconhecido por transformar conteû¤dos complexos em aprendizados claros e objetivos, exatamente o que vocûˆ precisa para dominarô ûÀcidos e basesô e toda a quûÙmica exigida no Enem.
Atravûˋs de videoaulas didûÀticas, exercûÙcios resolvidos e um planejamento de estudos focado nas reais necessidades do estudante, o Professor Ferretto e sua equipe criaram um caminho eficiente para a sua aprovaûÏûÈo.
Se vocûˆ quer melhorar seu desempenho em QuûÙmica e nas demais matûˋrias, conheûÏa a plataforma completa de preparaûÏûÈo. Comece organizando seus estudos de forma estratûˋgica e gratuita.
Baixe gratuitamente o Plano de Estudos Enem Anatomy!ô Ele vai ajudar vocûˆ a estruturar sua rotina e priorizar os temas mais importantes, comoô ûÀcidos e bases. Acesse agora.
E para uma preparaûÏûÈo ainda mais profunda e direcionada, com videoaulas do Professor Ferretto cobrindo toda a teoria deô ûÀcidos e bases, exercûÙcios de fixaûÏûÈo e resolvidos, alûˋm de todo o conteû¤do programûÀtico de QuûÙmica e das outras disciplinas, explore o curso completo.
Þô Prepare-se para o Enem com o Curso do Professor Ferretto!ô Domineô ûÀcidos e basesô e todos os temas decisivos com a metodologia que jûÀ aprovou milhares de estudantes. Comece hoje mesmo, experimente o curso gratuito.
Ao longo deste artigo, percorremos a fascinante jornada do conhecimento sobreô ûÀcidos e bases.
Partimos das definiûÏûçes clûÀssicas de Arrhenius, passamos pela visûÈo mais abrangente de BrûÑnsted-Lowry com seus pares conjugados e chegamos û poderosa teoria de Lewis, essencial para entender aô quûÙmica orgûÂnica.
Aprendemos a nomear corretamente esses compostos, identificamos sua presenûÏa ubûÙqua no nossoô dia a diaô e estabelecemos critûˋrios prûÀticos para distingui-los.
Mais do que isso, compreendemos a lû°gica por trûÀs das cobranûÏas noô Enem e vestibulares, que privilegiam a aplicaûÏûÈo do conhecimento em contextos reais e a resoluûÏûÈo de problemas.
Dominar o temaô ûÀcidos e basesô ûˋ, portanto, muito mais do que acumular informaûÏûçes; ûˋ desenvolver uma ferramenta de anûÀlise que serûÀ usada repetidamente na sua prova e na sua futura vida acadûˆmica.
Com estudo consistente, prûÀtica de exercûÙcios e um bom mûˋtodo de organizaûÏûÈo, como o oferecido pelo Professor Ferretto, vocûˆ transforma esse conteû¤do, que û primeira vista pode parecer desafiador, em um sû°lido aliado para conquistar a vaga dos seus sonhos.
Invista no seu aprendizado, pratique sem medo e lembre-se: cada conceito revisado ûˋ um passo a mais em direûÏûÈo û sua aprovaûÏûÈo!

