
Assuntos de quûÙmica que mais caem no Enem estûÈo entre as principais dû¤vidas de quem estuda para a prova de...

O calor especûÙfico ûˋ uma propriedade importante na fûÙsica que indica a quantidade de calor necessûÀria para alterar a temperatura de 1 grama de uma substûÂncia em 1 grau Celsius. Esse conceito ajuda a explicar por que materiais diferentes aquecem ou esfriam a diferentes velocidades e ûˋ essencial em situaûÏûçes cotidianas como regulaûÏûÈo climûÀtica e cozinhar. No contexto do Enem e vestibulares, entender o calor especûÙfico e sua fû°rmula pode ajudar a resolver questûçes interdisciplinares relacionadas a termodinûÂmica e energia. Alûˋm de discutir a definiûÏûÈo e importûÂncia do calor especûÙfico, o artigo tambûˋm aborda como calcular essa propriedade utilizando a fû°rmula clûÀssica da calorimetria Q = m.c.öT. Exemplos prûÀticos, como o cûÀlculo para aquecer a ûÀgua, sûÈo apresentados para consolidar o entendimento teû°rico e prûÀtico do tema. O artigo ainda explora a diferenûÏa entre calor especûÙfico e capacidade tûˋrmica, alûˋm de calor sensûÙvel e calor latente, preparando os estudantes para diversas abordagens que podem aparecer nas provas.
O Calor EspecûÙfico ûˋ uma propriedade fundamental das substûÂncias e explica por que alguns materiais esquentam ou esfriam mais rapidamente do que outros.
O Calor EspecûÙfico nos ajuda a explicar, por exemplo, a quantidade de calor necessûÀria para esquentar ûÀgua e o porquûˆ de a areia da praia queimar mais os pûˋs do que a ûÀgua do mar se a temperatura ambiente ûˋ a mesma.
û atravûˋs do Calor EspecûÙfico que se compara o aquecimento de diferentes materiais atravûˋs de uma fû°rmula prû°pria e, por conseguinte, o desenvolvimento de materiais mais eficientes na conduûÏûÈo do calor. NûÈo por menos, o tema tem sido cobrado nas provas para ingresso no ensino superior.
Neste artigo, portanto, vocûˆ entenderûÀô o que ûˋ Calor EspecûÙficoô de forma clara e objetiva. AprenderûÀ a aplicar aô fû°rmula do Calor EspecûÙfico, saberûÀ diferenciar Calor EspecûÙfico de conceitos comoô capacidade tûˋrmicaô e calor latente, e, o mais importante, aprenderûÀ a resolver as questûçes tûÙpicas doô Enem e vestibulares sobre o tema.
Em termos simples, oô calor especûÙfico (c)ô ûˋ uma propriedade fûÙsica que indicaô quantidade de calorô necessûÀria para alterar a temperatura deô 1 gramaô de uma substûÂncia emô 1 grau Celsiusô (ou 1 Kelvin).
Pense nele como uma “identidade tûˋrmica” de cada material: ele mede a “dificuldade” que uma substûÂncia tem para mudar sua temperatura.
Para entender o mundo que nos cerca. Para responder justamente a perguntas como, ãpor que alguns materiais esquentam mais rûÀpido que outros, mesmo recebendo a mesma quantidade de calor?”
Entender oô calor especûÙficoô ûˋ, portanto, entender fenûÇmenos naturais e tecnolû°gicos ao nosso redor.
O cûÀlculo envolvendoô calor especûÙficoô ûˋ direto e segue uma fû°rmula clûÀssica da calorimetria, que ûˋ a ûÀrea da fûÙsica que estuda a transferûˆncia de calor entre os corpos. O domûÙnio dela ûˋ essencial para resolver exercûÙcios que podem cair em sua prova.
A fû°rmula fundamental do Calor EspecûÙfico ûˋ derivada da equaûÏûÈo da Quantidade de Calor SensûÙvel, isto ûˋ, a quantidade de calor que um corpo recebe ou perde, causando apenas uma variaûÏûÈo em sua temperatura, sem que ocorra mudanûÏa em seu estado fûÙsico (sû°lido, lûÙquido ou gasoso).
Ela relaciona, portanto, o calor trocado por um corpo com a variaûÏûÈo de sua temperatura.A relaûÏûÈo ûˋ expressa pelaô EquaûÏûÈo Fundamental da Calorimetria:
Q = m.c.öT
Onde:
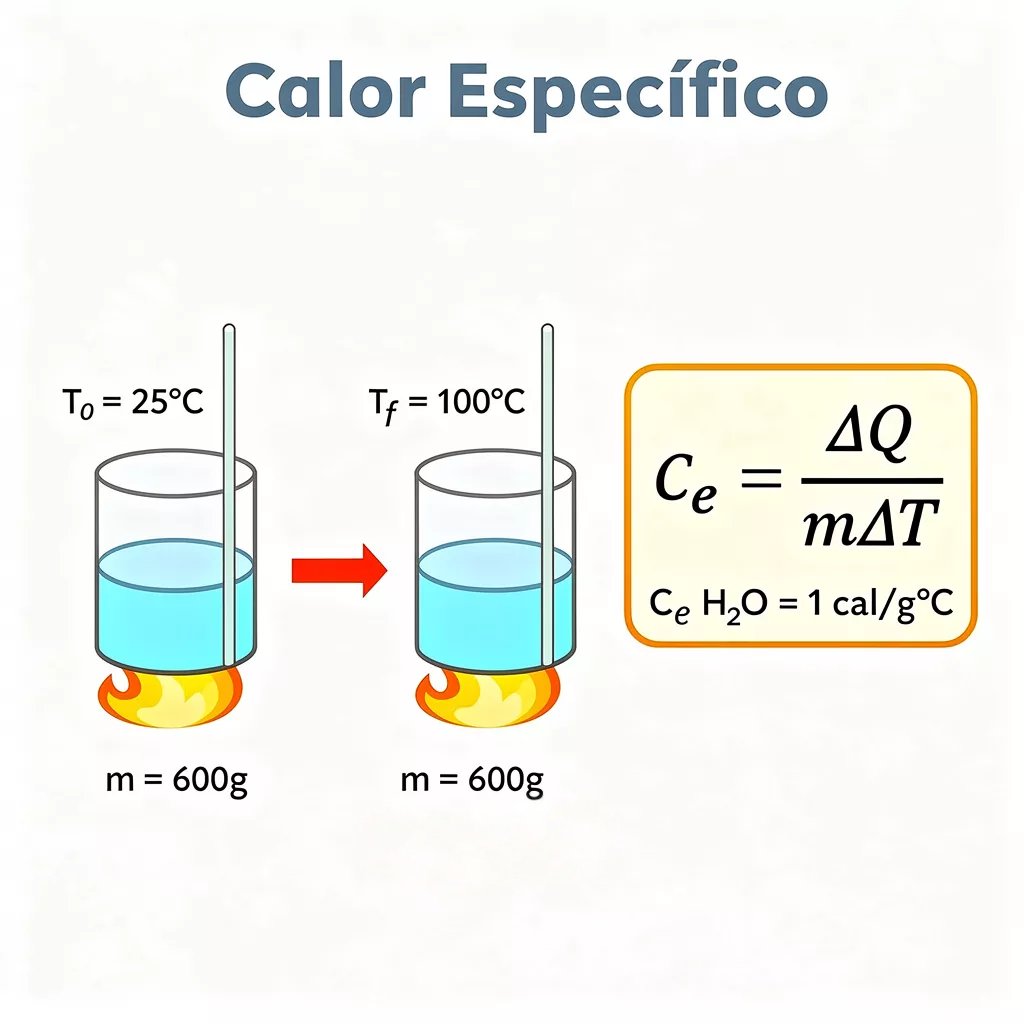
Exemplo prûÀtico: Vamos calcular a quantidade de calor necessûÀria para aquecer 500 g de ûÀgua de 20ô¯C para 80ô¯C. Sabemos que oô calor especûÙfico da ûÀguaô ûˋ c = 1 cal/gô¯C.
Portanto, sûÈo necessûÀrias 30.000 calorias para esse aquecimento.
Conhecer os valores tûÙpicos ajuda a ter intuiûÏûÈo para resolver problemas mais rapidamente. Veja esta tabela de referûˆncia:
| SubstûÂncia | Calor EspecûÙfico (cal/gô¯C) | Calor EspecûÙfico (J/kgô¯K)* |
|---|---|---|
| ûgua | 1,00 | 4180 |
| Gelo | ~0,50 | ~2090 |
| AlumûÙnio | 0,22 | ~900 |
| Ferro | 0,11 | ~460 |
| Cobre | 0,093 | ~390 |
| Chumbo | 0,031 | ~130 |
*Note que a unidade mais comum no SI ûˋ J/kgK. A conversûÈo ûˋ: 1 cal/gô¯C = 4180 J/kgK. Oô calor especûÙfico da ûÀguaô ûˋ o mais alto entre as substûÂncias comuns, um dado crucial.
Esses dois conceitos sûÈo irmûÈos, mas nûÈo sûÈo a mesma coisa, e as provas adoram cobrar essa distinûÏûÈo. Importante, pois, a diferenciaûÏûÈo para nûÈo confundir mais.
A relaûÏûÈo entre eles ûˋ direta: C = m.c
Ou seja, aô Capacidade Tûˋrmica (C)ô de um corpo ûˋ igual û sua massa multiplicada pelo seuô calor especûÙfico (c). A fû°rmula do calor fica, portanto:ô Q = C.öT.
Exemplo:ô Um bloco de 100g de alumûÙnio (c=0,22 cal/gô¯C) tem capacidade tûˋrmica C = 100 * 0,22 = 22 cal/ô¯C. JûÀ um bloco de 200g do mesmo alumûÙnio tem C = 44 cal/ô¯C (o dobro), mas oô calor especûÙficoô do material continua sendo 0,22 cal/gô¯C.
Outra confusûÈo comum ûˋ entre Calor SensûÙvel (envolvendo oô calor especûÙfico) e Calor Latente. A diferenûÏa ûˋ fundamental:
Resumindo:ô Use a fû°rmula doô calor especûÙficoô quando a questûÈo falar em “aquecer”, “resfriar”, “variaûÏûÈo de temperatura”. Use a fû°rmula do calor latente quando a questûÈo falar em “derreter”, “vaporizar”, “solidificar”, “condensar”ô sem mudar a temperatura.
A abordagem ûˋ contextualizada e interdisciplinar. Oô calor especûÙficoô frequentemente aparece:
Abaixo imagem do inûÙcio da fervura de ûÀgua que tem calor especûÙfico bem mais alto que o metal da panela.

Vamos aplicar os conceitos e fû°rmulas vistos acima em casos prûÀticos de resoluûÏûÈo de questûçes de ENEM e vestibular.
Na montagem de uma cozinha para um restaurante, a escolha do material correto para as panelas ûˋ importante, pois a panela que conduz mais calor ûˋ capaz de cozinhar os alimentos mais rapidamente e, com isso, hûÀ economia de gûÀs. A taxa de conduûÏûÈo do calor depende da condutividade k do material da sua ûÀrea A, da diferenûÏa de temperatura öT e da espessura d do material, sendo dada pela relaûÏûÈo
![]()
Em panelas com dois materiais, a taxa de conduûÏûÈo ûˋ dada por
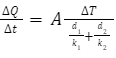
em que d1ô e d2ô sûÈo as espessuras dos dois materiais, eô ô K1ô e K2ô sûÈo as condutividades de cada material. Os materiais mais comuns no mercado para panelas sûÈo o alumûÙnio (k = 20 W/m K), o ferro (k = 8 W/m K) e o aûÏo (k = 5 W/m K) combinado com o cobre (k = 40 W/m K).
Compara-se uma panela de ferro, uma de alumûÙnio e uma composta de 1/2ô da espessura em cobre e 1/2 da espessura em aûÏo, todas com a mesma espessura total e com a mesma ûÀrea de fundo.
A ordem crescente da mais econûÇmica para a menos econûÇmica ûˋ
A) cobre-aûÏo, alumûÙnio e ferro.
B) alumûÙnio, cobre-aûÏo e ferro
C) cobre-aûÏo, ferro e alumûÙnio
D) alumûÙnio, ferro e cobre-aûÏo
E) ferro, alumûÙnio e cobre-aûÏo
ResoluûÏûÈo: Note que em relaûÏûÈo û panela de ferro e a de alumûÙnio nûÈo precisamos nem realizar cûÀlculos? Por quûˆ? Porque a espessura das panelas e o seu tamanho, a ûÀrea, portanto ûˋ a mesma, o û¤nico nû¤mero que muda ûˋ a prû°pria condutividade. Assim, a condutividade do material jûÀ revela a mais eficiente. Logo, a de alumûÙnio ûˋ melhor que a de ferro.
O problema efetivamente reside na panela de metal composto. Como proposto na questûÈo, a fû°rmula da panela mista (taxa de conduûÏûÈo de calor) ûˋ dada por = 1/[ (d1/k1) + (d2/k2)]. Como a espessura de cada material (cobre e aûÏo) serûÀ justamente a metade da parede da panela, temos: d1=0,5 e d2=0,5.
Logo: 1[(0,5/40) + (0,5/5)] ÞÀˆ 1[0.0125 + 0,1] ÞÀˆ 1/0,1125 = 8,88
A condutividade da panela mista de cobre e aûÏo ûˋ 8,88, um pouco melhor do que a de ferro que ûˋ 8. Assim a alternativa correta ûˋ a letra B, pois ordena de forma crescente as panelas da mais econûÇmica û menos econûÇmica.
AtenûÏûÈo! Cuidado para nûÈo querer, nesses casos, fazer a mûˋdia dos materiais. Cobre e ferro [(40+5)/2] que dûÀ 22,5. Um erro! Pois vocûˆ diria que essa panela ûˋ melhor atûˋ do que a de alumûÙnio. O cobre ûˋ bom condutor, mas o calor tem dificuldade para atravessar o aûÏo. û algo semelhante quando vocûˆ segura no cabo de uma panela quente. O calor nûÈo ûˋ uniformemente distribuûÙdo, daûÙ nûÈo se poder fazer a mûˋdia.
(Fuvest-SP Adaptada)ô Um bloco de massa 2,0 kg, feito de um material com calor especûÙfico de 0,20 cal/gô¯C, inicialmente a 60ô¯C, ûˋ colocado em contato com 1,0 kg de ûÀgua, a 20ô¯C. Desprezando perdas e considerando o calor especûÙfico da ûÀgua = 1,0 cal/gô¯C, qual a temperatura final de equilûÙbrio tûˋrmico?
ResoluûÏûÈo:
Passo 1: Entenda.ô Dois corpos com temperaturas diferentes trocam calor atûˋ igualar a temperatura (Tf). O calor que o bloco quente perde (Q_perdido) ûˋ igual ao que a ûÀgua fria ganha (Q_ganho).ô Q_perdido + Q_ganho = 0.
Passo 2: Padronize unidades.ô Massa do bloco = 2000 g. Massa da ûÀgua = 1000 g.
Passo 3: Aplique a fû°rmula para cada corpo.
Passo 4: Use o princûÙpio: Q_bloco + Q_ûÀgua = 0.
2000 . 0,20 . (Tf – 60) + 1000 . 1,0 . (Tf – 20) = 0
400 . (Tf – 60) + 1000 . (Tf – 20) = 0
400Tf – 24000 + 1000Tf – 20000 = 0
1400Tf – 44000 = 0
1400Tf = 44000
Tf = 31,43ô¯C
Resposta:ô A temperatura final de equilûÙbrio serûÀ de aproximadamenteô 31,4ô¯C.
O principal ûˋ ter clareza sobre os conceitos, bem como as fû°rmulas comumente utilizadas e unidades de medida especûÙficas. Buscar relacionar a teoria com fenûÇmenos do dia a dia. Abaixo um quadro que pode auxiliûÀ-lo em seus estudos.
Dominar a teoria e praticar a resoluûÏûÈo de exercûÙcios, portanto, ûˋ a chave. Mesmo assim, muitos estudantes se perdem por falta de umô mûˋtodo organizadoô e de umô planejamento eficienteô que mostre exatamente o que cai em cada prova e como isso ûˋ cobrado.
û aqui que umô acompanhamento especializadoô faz toda a diferenûÏa. Cursos como os oferecidos peloô Professor Ferrettoô sûÈo projetados exatamente para preencher essa lacuna. A plataforma se destaca por apresentar:
Para vocûˆ que quer transformar a FûÙsica e as Ciûˆncias da Natureza em um grande diferencial na sua nota,ô comeûÏar por um material de qualidade ûˋ o primeiro passo. O Professor Ferretto disponibiliza umô curso gratuitoô robusto, que jûÀ ûˋ um excelente ponto de partida para construir sua base.
Þ Quer dominar o Calor EspecûÙfico e todos os outros tû°picos de FûÙsica do Enem?
Acesse agora o Curso Gratuito do Professor Ferrettoô e veja como a preparaûÏûÈo pode ser direta e eficiente.
Þ E para uma preparaûÏûÈo completa, com planos de estudo, monitorias e todo o suporte para mandar bem no Enem, conheûÏa o ENEM ANATOMY.
Oô calor especûÙficoô explica desde fenûÇmenos globais atûˋ simples situaûÏûçes do nosso dia a dia. Para o estudante que mira oô Enem e os vestibulares, dominar esse tema ûˋ necessûÀrio para resolver problemas interdisciplinares envolvendo termodinûÂmica, energia e meio ambiente.
Importante ter presente, portanto, que Calor EspecûÙfico ûˋ quantidade de calorô necessûÀria para alterar a temperatura deô 1 gramaô de uma substûÂncia emô 1 grau Celsiusô (ou 1 Kelvin).
A partir disso, domine as fû°rmulas envolvidas para os cûÀlculos necessûÀrios. Saiba a diferenûÏa entreô capacidade tûˋrmicaô e calor especûÙfico, e, principalmente,ô pratique com exercûÙcios de provas reais.
Com organizaûÏûÈo e o material certo de apoio, vocûˆ transforma o tema Calor EspecûÙfico de um desafio a uma oportunidade de brilhar.
Agora ûˋ com vocûˆ: pegue os conceitos deste artigo, associe-os û s questûçes e dûˆ o prû°ximo passo na sua preparaûÏûÈo.

