
Assuntos de quûÙmica que mais caem no Enem estûÈo entre as principais dû¤vidas de quem estuda para a prova de...

Os elementos quûÙmicos sûÈo fundamentais para a constituiûÏûÈo de toda a matûˋria, sendo eles os blocos bûÀsicos que constituem o universo. Esses elementos sûÈo definidos pelo nû¤mero de prû°tons em seus nû¤cleos, conhecido como nû¤mero atûÇmico. O estudo dos elementos quûÙmicos, suas propriedades e como sûÈo cobrados em provas como o ENEM, ûˋ essencial para compreender reaûÏûçes quûÙmicas e suas aplicaûÏûçes prûÀticas no dia a dia. A Tabela Periû°dica organiza os elementos quûÙmicos de acordo com propriedades semelhantes, facilitando a anûÀlise e previsûÈo de comportamentos. Ela classifica os elementos em grupos (metais alcalinos, metais alcalino-terrosos, halogûˆnios, etc.) e suas propriedades periû°dicas, como raio atûÇmico, eletronegatividade e energia de ionizaûÏûÈo. Compreender essas propriedades ûˋ crucial para antecipar como os elementos se comportarûÈo em reaûÏûçes quûÙmicas. O artigo tambûˋm explora a aplicaûÏûÈo dos elementos quûÙmicos no cotidiano, como em medicamentos, eletrûÇnicos e alimentos. O conhecimento sobre esses elementos e suas reaûÏûçes tambûˋm ûˋ essencial para resolver questûçes do ENEM, que frequentemente exigem a interpretaûÏûÈo da Tabela Periû°dica e a aplicaûÏûÈo de conceitos em situaûÏûçes-problema.
Os elementos quûÙmicos sûÈo a base de tudo o que existe, pois sûÈo os verdadeiros “tijolos” que constituem toda a matûˋria do universo, desde a cadeira em que vocûˆ estûÀ sentado atûˋ o ar que se respira. NûÈo por menos, esse tema ûˋ comumente cobrado nas provas para ingresso nas universidades.
NûÈo podemos, contudo, querer memorizar os 118 elementos quûÙmicos, atûˋ porque isso nûÈo seria de tûÈo grande utilidade. Muito mais û¤til ûˋ ter uma boa noûÏûÈo de suas propriedades, como os elementos quûÙmicos sûÈo organizados e, principalmente, como esses conhecimentos sûÈo cobrados nas provas. Nosso objetivo, pois, ûˋ conectar a teoria sobre elementos quûÙmicos com fenûÇmenos quûÙmicos (as reaûÏûçes quûÙmicas) que nos cercam no dia a dia. Por isso, siga conosco.
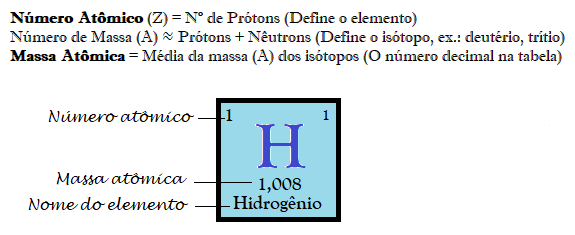
Em sua definiûÏûÈo mais pura, umô elemento quûÙmicoô ûˋ uma substûÂncia composta por um û¤nico tipo de ûÀtomo. O que diferencia um elemento do outro ûˋ o nû¤mero de prû°tons em seu nû¤cleo, o chamadoô nû¤mero atûÇmico (Z). Por exemplo, todo ûÀtomo que possui 1 prû°ton ûˋ Hidrogûˆnio.
Todo ûÀtomo com 6 prû°tons ûˋ Carbono. Isso ûˋ dizer que cada elemento quûÙmico sû° tem uma û¤nica quantidade possûÙvel de prû°tons em seu nû¤cleo.
Esse ûˋ um dado muito curioso. SenûÈo vejamos, caso vocûˆ pudesse isolar um û¤nico prû°ton de um ûÀtomo de Ferro e um û¤nico ûÀtomo de Oxigûˆnio, vocûˆ nûÈo conseguiria distinguir a diferenûÏa entre esses prû°tons.
Isso significa que todos os prû°tons da natureza sûÈo exatamente iguais, o mesmo ocorre com os nûˆutrons e elûˋtrons. Basta, porûˋm, acrescentar um û¤nico prû°ton a um determinado ûÀtomo que ele se transforma em um ûÀtomo de um elemento por vezes muito distinto do outro. Assim, se vocûˆ acrescentar um û¤nico prû°ton a um ûÀtomo de Oxigûˆnio, vocûˆ terûÀ em seu lugar o Flû¤or. De se ver, portanto, como ûˋ fantûÀstica a quûÙmica em seu nûÙvel fundamental.
û crucial nûÈo confundir elementos com substûÂncia simples ou composta. Um elemento pode formar substûÂncias simples (como o gûÀs Oxigûˆnio, Oã, formado apenas por ûÀtomos de oxigûˆnio) ou participar da formaûÏûÈo de inû¤meras substûÂncias compostas atravûˋs deô reaûÏûçes quûÙmicas.
û isso que ocorre, por exemplo, quando o Sû°dio (Na) reage com o Cloro (Cl) para formar o cloreto de sû°dio (NaCl – o sal de cozinha). Temos, pois, dois elementos combinando para criar um composto.
Esse novo composto, nûÈo raro, tem caracterûÙsticas bem diversas dos elementos ou substûÂncias que o formaram. Entender os elementos individualmente ûˋ o primeiro passo para prever o comportamento deles quando interagem.
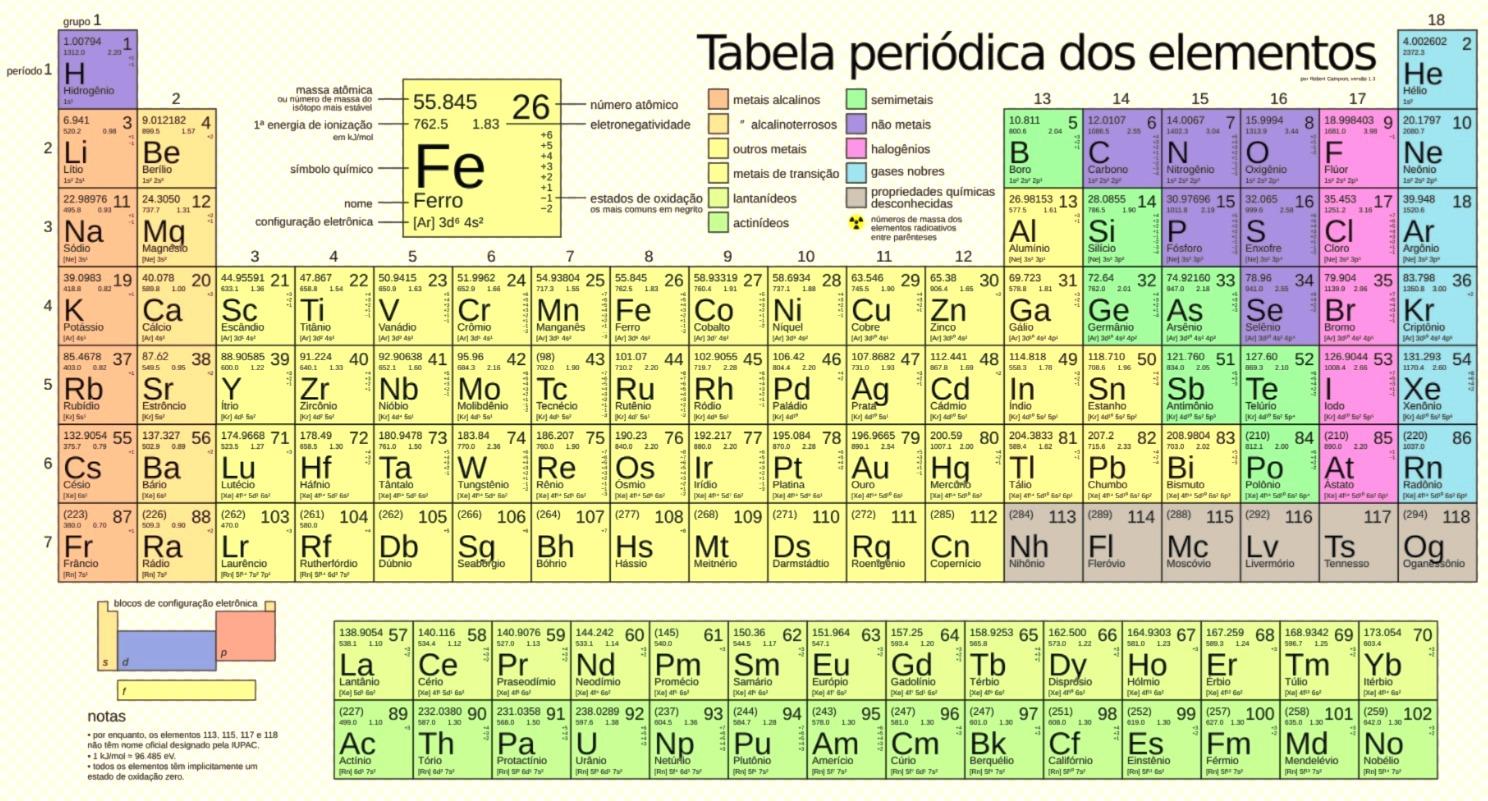
Os elementos quûÙmicos, como vimos acima, estûÈo todos representados na Tabela Periû°dica. Por essa razûÈo, ela vai muito alûˋm de um pûÇster colorido na parede da sala de aula, ou daquela cartela colorida utilizada nas aulas de quûÙmica. A tabela periû°dica, ûˋ o grande mapa da QuûÙmica.
Inicialmente ela foi organizada principalmente pelo quûÙmico Dmitri Mendeleev. Com o tempo, foi aprimorada e atualmente ela agrupa os elementos com propriedades semelhantes, facilitando sua anûÀlise e previsûÈo de comportamento, daûÙ ser como um mapa, pois nela se busca as orientaûÏûçes.
Os elementos sûÈo dispostos em:
Indicam o nû¤mero de camadas eletrûÇnicas que o ûÀtomo possui. SûÈo as linhas horizontais (de cima para baixo, sûÈo 7).
Eles indicam o nû¤mero de camadas eletrûÇnicas (nûÙveis de energia) que o ûÀtomo possui, isto ûˋ, as camadas pelas quais os elûˋtrons do ûÀtomo estûÈo distribuûÙdos.
Abaixo quadro ilustrativo das 7 diferentes camadas de energia com o respectivo nû¤mero mûÀximo de elûˋtrons que o ûÀtomo pode conter em cada nûÙvel ou camada.
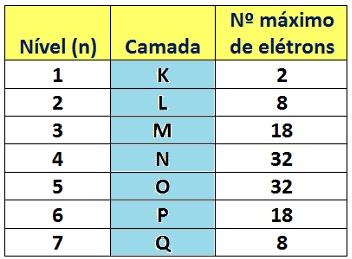
SûÈo as colunas verticais (de 1 a 18). Agrupam elementos com a mesma configuraûÏûÈo na camada de valûˆncia (elûˋtrons na û¤ltima camada), o que lhes confere propriedades quûÙmicas semelhantes.
Os grupos tambûˋm sûÈo chamados de famûÙlias dos elementos. Veja os principais grupos ou famûÙlias na tabela periû°dica abaixo:
As principais propriedades dos elementos incluem caracterûÙsticas como raio atûÇmico, eletronegatividade, energia de ionizaûÏûÈo, afinidade eletrûÇnica. Essas propriedades sûÈo conhecidas como propriedades periû°dicas. Alûˋm dessas tambûˋm hûÀ as chamadas propriedades nûÈo periû°dicas, como a massa atûÇmica. Vejamos abaixo cada uma dessa propriedades de forma mais detalhada.
Essas propriedades periû°dicas variam de forma previsûÙvel na tabela periû°dica em que os elementos estûÈo ordenados segundo seu nû¤mero atûÇmico, isto ûˋ, conforme a quantidade de prû°tons do ûÀtomo contûˋm em seu nû¤mero.
Vejamos abaixo as principais propriedades dos elementos quûÙmicos:
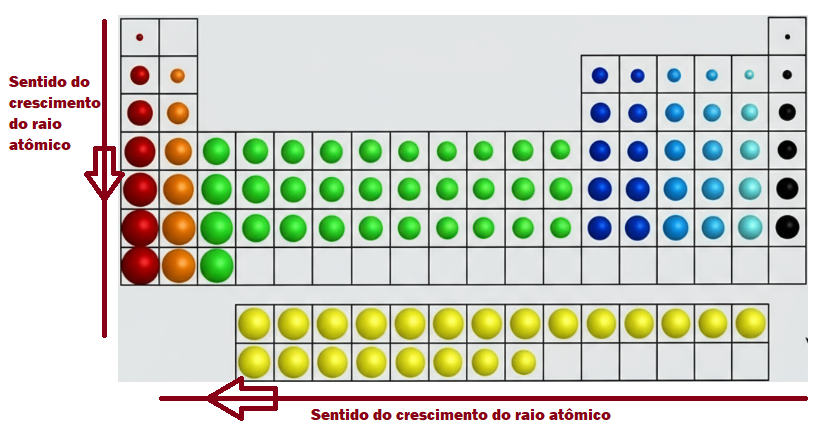
Tamanho do ûÀtomo. Aumenta de cima para baixo em um grupo e da direita para a esquerda em um perûÙodo. Note que esse comportamento se deve pelas razûçes a seguir. De cima para baixo em um grupo, pois cala elemento sucessivo tem uma camada eletrûÇnica adicional. JûÀ a diminuiûÏûÈo da esquerda para a direita (ou aumento da direita para a esquerda) se deve ao fato de que, quanto mais û direita em um perûÙodo um elemento estiver na tabela, mais prû°tons esse ûÀtomo tem em seu nû¤cleo e essa quantidade maior de prû°tons tende a atrair os elûˋtrons mais para o seu centro, daûÙ o raio se tornar menor. Com a visualizaûÏûÈo do quadro a seguir fica mais fûÀcil a compreensûÈo da variaûÏûÈo do raio atûÇmico.
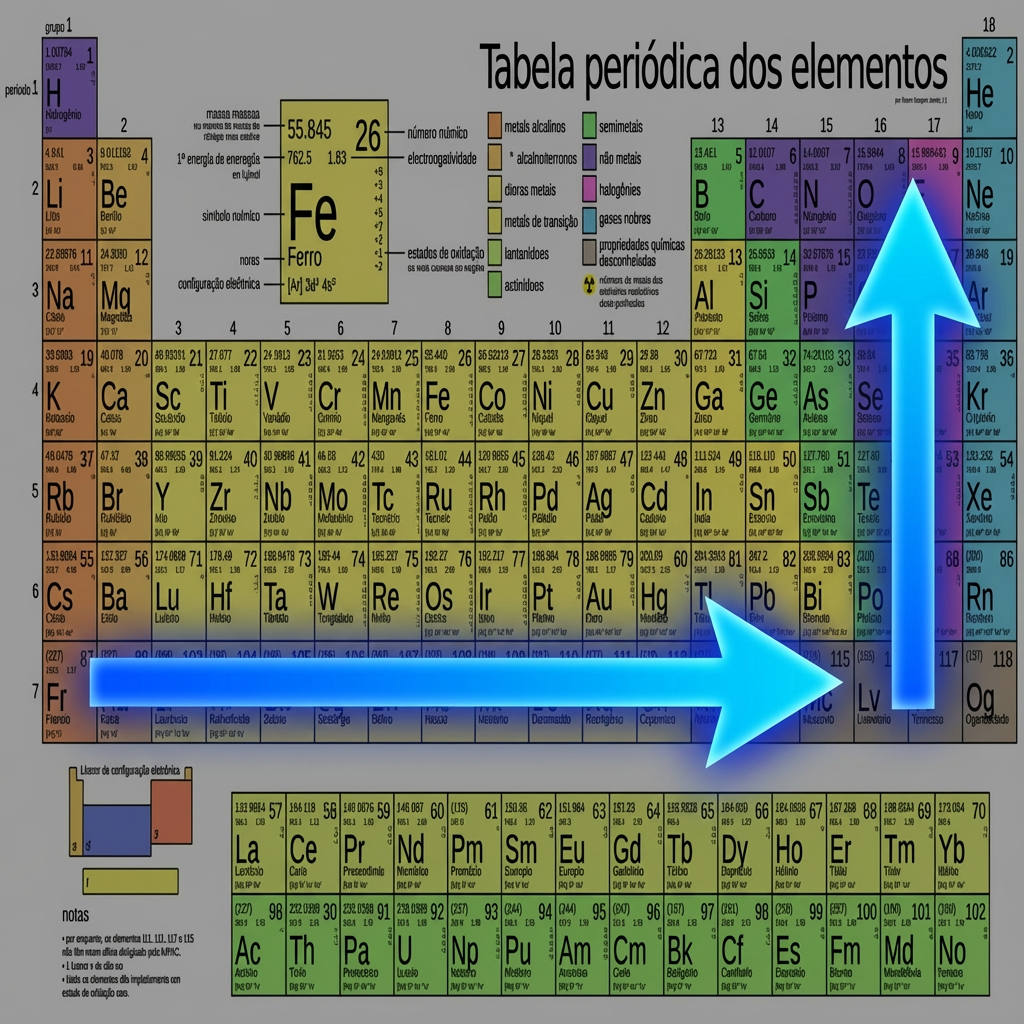
Capacidade de um ûÀtomo de atrair elûˋtrons em uma ligaûÏûÈo quûÙmica. Essa propriedade ûˋ fundamental para prever o tipo de ligaûÏûÈo (iûÇnica ou covalente) e o comportamento dos elementos nasô reaûÏûçes quûÙmicas.
A eletronegatividade aumenta da esquerda para a direita (salvo os gases nobres) no perûÙodo e de baixo para cima no grupo. û por essa razûÈo que o Flû¤or (F) ûˋ o campeûÈo de eletronegatividade! Localize-se o na tabela para uma melhor visualizaûÏûÈo e compreensûÈo. Abaixo ilustraûÏûÈo do sentido do crescimento da eletronegatividade na tabela.
Energia necessûÀria para remover um elûˋtron de um ûÀtomo neutro. û crucial para entender a formaûÏûÈo de ûÙons e a ligaûÏûÈo iûÇnica. Segue a mesma tendûˆncia da eletronegatividade (aumenta no perûÙodo, diminui na famûÙlia).
Energia liberada quando um ûÀtomo ganha um elûˋtron. Tambûˋm segue a tendûˆncia da eletronegatividade.
Reflete a tendûˆncia de um ûÀtomo perder elûˋtrons. Segue a tendûˆncia OPOSTA û eletronegatividade. Aumenta da direita para a esquerda no perûÙodo e de cima para baixo na famûÙlia.
Essas propriedades nûÈo seguem uma variaûÏûÈo especûÙfica na tabela, como o nû¤mero de massa. A Massa AtûÇmica ûˋ a forma padrûÈo para medir a massa dos ûÀtomos, expressa em unidade de massa atûÇmica (u).
Na natureza podemos encontrar elementos quûÙmicos com o mesmo nû¤mero atûÇmico, mas com massas atûÇmicas diferentes. Estes elementos sûÈo chamados de isû°topos, que nada mais sûÈo que ûÀtomos do mesmo elemento quûÙmico e que possuem o mesmo nû¤mero de prû°tons, mas nû¤mero diferente de nûˆutrons. DaûÙ resulta terem massa atûÇmica distinta. Simples assim.
Para exemplificar, pode-se citar o deutûˋrio e o trûÙtio. Ambos sûÈo isû°topos do hidrogûˆnio. O deutûˋrio, assim como o hidrogûˆnio, tem 1 prû°ton, mas adicionalmente tem 1 nûˆutron, jûÀ o trûÙtio conta com 2 nûˆutrons, mas tambûˋm sû° 1 prû°ton.
Abaixo a ilustraûÏûÈo da representaûÏûÈo do Hidrogûˆnio com a anotaûÏûÈo de alguns elementos identificadores.
Vimos acima as propriedades dos elementos quûÙmicos. Como vocûˆ deve saber todos os elementos quûÙmicos estûÈo representados na Tabela Periû°dica e, embora existam 118 elementos conhecidos, vocûˆ nûÈo precisa decorar todos. Atenha-se principalmente û classificaûÏûÈo por grupos e propriedades. Assim vocûˆ serûÀ capaz de identificar rapidamente caraterûÙsticas semelhantes de elementos quûÙmicos pertencentes a um mesmo grupo. Abaixo, para seu auxûÙlio, segue a tabela periû°dica com a representaûÏûÈo dos elementos e seus fatores identificativos.
A teoria ganha vida quando aplicada ao dia a dia. Os elementos, por conseguinte, nûÈo estûÈo confinados aos laboratû°rios; eles estûÈo em tudo, literalmente em tudo, ao nosso redor, e entender isso ûˋ uma das melhores formas de fixar o conteû¤do.
Vejamos abaixo alguns exemplos da presenûÏa e importûÂncia de alguns elementos quûÙmicos no nosso dia a dia.
O LûÙtio (Li) ûˋ usado no tratamento do transtorno bipolar. O Ferro (Fe) ûˋ a base de suplementos para anemia. Por quûˆ? Porque o Ferro ûˋ quem transporta o Oxigûˆnio para as cûˋlulas onde reagem com a glicose para produzir energia, o que, como vocûˆ jûÀ deve saber, ûˋ o que chamamos de respiraûÏûÈo celular.
O Ferro, portanto, ûˋ o transportador do oxigûˆnio em nosso corpo. DaûÙ que ter deficiûˆncia de Ferro causa anemia, pois o organismo nûÈo ûˋ capaz de transportar oxigûˆnio necessûÀrio para as cûˋlulas.
Tambûˋm podemos citar os antibiû°ticos como a penicilina que contûˋm Enxofre (S). O entendimento desses elementos permite o desenvolvimento de novos fûÀrmacos atravûˋs de complexasô reaûÏûçes quûÙmicasô de sûÙntese.
O SilûÙcio (Si) ûˋ o coraûÏûÈo de todos os chips e processadores. ûtrio (Y) e Eurû°pio (Eu) sûÈo usados para criar a cor vermelha em telas de TV e smartphones. O Niû°bio (Nb) ûˋ um metal brasileiro crûÙtico para a produûÏûÈo de superligas usadas em turbinas e ûÙmûÈs supercondutores.
Alûˋm disso, vocûˆ jûÀ deve ter ouvido o termo ãterras-rarasã, muito em voga ultimamente. As terras-raras sûÈo um grupo de 17 elementos quûÙmicos essenciais para a tecnologia moderna.
Utilizados em Smartphones e atûˋ equipamentos militares de defesa. Incluem os lantanûÙdeos, EscûÂndio (SC) e Ytrio (Y), principalmente.
O Sû°dio (Na) e o PotûÀssio (K) sûÈo essenciais para o equilûÙbrio celular. O CûÀlcio (Ca) fortalece ossos e dentes. O Magnûˋsio (Mg) ativa enzimas no organismo.
A fotossûÙntese, processo vital para a produûÏûÈo de alimentos, ûˋ uma dasô reaûÏûçes quûÙmicasô mais importantes, envolvendo Carbono (C), Hidrogûˆnio (H) e Oxigûˆnio (O).
A exploraûÏûÈo de elementos como o Ouro (Au) e o AlumûÙnio (Al) pode causar devastaûÏûÈo ambiental se nûÈo for feita de forma sustentûÀvel.
Por outro lado, elementos como o LûÙtio (Li) e o Cobalto (Co) sûÈo vitais para a produûÏûÈo de baterias de carros elûˋtricos, uma tecnologia de baixo carbono. A quûÙmica ambiental estuda justamente asô reaûÏûçes quûÙmicasô dos poluentes na atmosfera e na ûÀgua.
No inûÙcio dissemos que os elementos quûÙmicos sûÈo a base de tudo o que existe. Os elementos quûÙmicos estûÈo, portanto, presentes na fûÙsica e biologia. Vamos ilustrar rapidamente.
As provas nûÈo perguntam simplesmente “qual o sûÙmbolo do Ferro?”. Elas cobram a capacidade de relacionar conceitos, interpretar a tabela periû°dica e aplicar o conhecimento em situaûÏûçes-problema.
As questûçes frequentemente envolvem a previsûÈo dos produtos deô reaûÏûçes quûÙmicasô com base na localizaûÏûÈo dos elementos na tabela.
Abordagens Comuns:
No ar que respiramos existem os chamados ãgases inertesã. Trazem curiosos nomes gregos, que significam ão Novoã, ão Ocultoã, ão Inativoã.
E de fato sûÈo de tal modo inertes, tûÈo satisfeitos em sua condiûÏûÈo, que nûÈo interferem em nenhuma reaûÏûÈo quûÙmica, nûÈo se combinam com nenhum outro elemento e justamente por esse motivo ficaram sem ser observados durante sûˋculos.
Sû° em 1962 um quûÙmico, depois de longos e engenhosos esforûÏos, conseguiu forûÏar ão Estrangeiroã (o xenûÇnio) a combinar-se fugazmente com o flû¤or ûÀvido e vivaz, e a faûÏanha pareceu tûÈo extraordinûÀria que lhe foi conferido o Prûˆmio Nobel Qual propriedade do flû¤or justifica sua escolha como reagente para o processo mencionado?
LEVI, P.ô A tabela periû°dica.ô Rio de Janeiro: Relume-DumarûÀ, 1994 (adaptado)
A) Densidade.
B) CondutûÂncia.
C) Eletronegatividade.
D) Estabilidade nuclear.
E) Temperatura de ebuliûÏûÈo
SoluûÏûÈo:Vimos acima que o Flû¤or (Fl) ûˋ o campeûÈo de eletronegatividade, isto ûˋ, tem alta capacidade de atrair elûˋtrons. Por essa razûÈo, embora o XenûÇnio (Xe) seja extremamente estûÀvel, a alta capacidade de atraûÏûÈo de elûˋtrons do Fl foi capaz de capturar os elûˋtrons do Xe, unindo-se a ele. Logo, alternativa correta letra ãCã.
I ã Determinado elemento metûÀlico pertence ao terceiro perûÙodo da ClassificaûÏûÈo Periû°dica e apresenta dois elûˋtrons em seu nûÙvel eletrûÇnico mais energûˋtico. Esse elemento, comumente empregado em medicamentos para o combate û azia, ûˋ representado pelo sûÙmbolo:
a) K.
b) Ca.
c) Na.
d) Mg.
e) Mn.
SoluûÏûÈo:ô Para comeûÏar, somente o Sû°dio (Na) e o Magnûˋsio (Mg) pertencem ao terceiro perûÙodo, os demais sûÈo do quarto. Como vocûˆ jûÀ sabe, o sû°dio estûÀ presente no sal e o magnûˋsio no tal ãleite de magnûˋsioã, que se toma justamente quando se estûÀ com azia. De se ver que, mesmo sem um conhecimento aprofundado, ûˋ possûÙvel resolver corretamente a questûÈo. Por conseguinte, alternativa correta letra ãdã.
Esta pergunta surge de um equûÙvoco comum e talvez vocûˆ jûÀ tenha topado com ela. Na filosofia antiga, propunha-se que a matûˋria era feita de elementos como terra, ar, fogo e ûÀgua.
Observe que eles confundiam uma substûÂncia, como a ûÀgua, com o fenûÇmeno de uma reaûÏûÈo como a combustûÈo, o fogo, por exemplo. Isso se dava justamente por desconhecerem as caracterûÙsticas de um elemento quûÙmico, de uma substûÂncia e de uma reaûÏûÈo quûÙmica. Hoje, na ciûˆncia moderna, apû°s anos de estudos e descobertas, jûÀ nûÈo falamos em “7 ou 8 elementos da natureza”, pois sequer fazem muito sentido.
Por essa razûÈo, trabalha-se com osô 118 elementos quûÙmicosô confirmados pela IUPAC. O conceito de “partûÙculas da natureza” ûˋ mais adequado û FûÙsica, que estuda partûÙculas subatûÇmicas como prû°tons, nûˆutrons, elûˋtrons, quarks, etc.
Atualmente, a tabela periû°dica oficial, como jûÀ vimos acima, reconheceô 118 elementos. Os elementos de 1 a 94 (do Hidrogûˆnio ao PlutûÇnio) sûÈo encontrados na natureza, enquanto os elementos de 95 a 118 foram sintetizados em laboratû°rio.
Os seres vivos sûÈo formados basicamente pelos seguintes elementos: Carbono (C), Hidrogûˆnio (H), Oxigûˆnio (O), Nitrogûˆnio (N), Fû°sforo (F) e Enxofre (S).
Os elementos quûÙmicos sûÈo formados por um processo de fusûÈo nuclear no interior de estrelas. Quando estrelas maiores envelhecem e explodem, elas formam os elementos mais pesados que sûÈo espalhados pelo cosmos. Novas estrelas e planetas se formam a partir desses remanescentes. O ferro que estûÀ no seu sangue jûÀ esteve literalmente no interior de uma estrela. NûÈo ûˋ errado, pois, dizer que somos filhos de estrelas.
Para potencializar ao mûÀximo seus estudos, uma plataforma organizada e completa faz toda a diferenûÏa.
Oô Professor Ferrettoô oferece um curso focado no Enem e vestibulares, com uma didûÀtica que simplifica a QuûÙmica, desde osô elementos quûÙmicosô atûˋ asô reaûÏûçes quûÙmicasô mais complexas.
Eles fornecem todo o material estruturado para vocûˆ nûÈo se perder.
Quer aprofundar seus estudos? Acesse o ENEMãs Anatomy para ver os principais temas que caem de quûÙmica no exame.
E, para comeûÏar a se preparar agora mesmo, vocûˆ pode experimentar gratuitamente a plataforma:
Comece Gratuitamente! Acesse o curso completo do Professor Ferretto.
Dominar osô elementos quûÙmicosô ûˋ muito mais do que uma etapa do estudo, ûˋ a base sobre a qual se assenta todo o estudo da quûÙmica.
Saber o que identifica um elemento quûÙmico, compreender sua classificaûÏûÈo por perûÙodos e grupos e, por consequûˆncia, as caracterûÙsticas semelhantes, faz com que vocûˆ tenha uma melhor compreensûÈo de como se dûÀ a dinûÂmica entre interaûÏûçes de elementos quûÙmicos, isto ûˋ, as reaûÏûçes quûÙmicas.
A partir disso vocûˆ terûÀ uma facilidade maior de identificar as propriedades de um elemento, ou mesmo de uma substûÂncia quûÙmica e sua utilidade no mundo real, nas coisas que nos cercam.
Esse conhecimento ûˋ a chave para desvendar desde questûçes simples atûˋ os problemas mais interdisciplinares do Enem e dos vestibulares. Coloque as dicas em prûÀtica, estude com estratûˋgia.
A compreensûÈo, portanto, de umaô reaûÏûÈo quûÙmicaô comeûÏa com o conhecimento das caracterûÙsticas dos elementos que a compûçem.
Bons estudos!

