
Assuntos de química que mais caem no Enem estão entre as principais dúvidas de quem estuda para a prova de...

Misturas homogêneas são composições uniformes de duas ou mais substâncias, onde as propriedades são constantes em toda a extensão da amostra. Um exemplo clássico é uma solução de água e açúcar, onde o açúcar se dissolve completamente na água, tornando impossível distinguir um do outro a olho nu. No contexto de estudos para o Enem e vestibulares, entender esse tipo de mistura é crucial, pois questões frequentemente exploram a compreensão dos alunos sobre soluções em diferentes estados físicos. Além dos conceitos básicos, as provas muitas vezes testam o conhecimento de aplicações práticas e teóricas dessas misturas, como a preparação de soluções em laboratórios e a influência da temperatura e pressão nas suas propriedades. Estudantes são incentivados a familiarizar-se tanto com a nomenclatura quanto com as características químicas envolvidas, garantindo uma visão completa do tema. Para se preparar de forma eficaz, é fundamental que os alunos pratiquem perguntas frequentes sobre o tema e revisem exemplos comuns de laboratório e do dia a dia. Aprofundar-se em tópicos relacionados, como osmose, pode ajudar a construir um entendimento mais robusto, essencial para projetos acadêmicos e para a própria prova do Enem.
O tema misturas é um tema recorrente da prova de Ciências da Natureza. Assim, entender o que são misturas homogêneas pode ser a chave para resolver problemas sobre soluções, concentração, propriedades coligativas e, até mesmo, processos industriais e ambientais.
Você já se deparou com uma questão que mencionava “solução aquosa”, “sistema de uma fase” ou “mistura uniforme” e ficou em dúvida? Ou talvez a dificuldade esteja em diferenciar, uma mistura homogênea de uma heterogênea, ou em memorizar os métodos de separação de misturas homogêneas.
Se esses são os seus desafios, você está no lugar certo. Aqui, vamos descomplicar esses conceitos, trazendo exemplos do cotidiano, comparativos detalhados e, principalmente, mostrando como esse conteúdo é cobrado no Enem.
Vamos além da teoria, oferecendo exercícios resolvidos e estratégias de estudo comprovadas. Portanto, prepare seu caderno de anotações e vamos mergulhar neste tema fundamental.
Em Química, uma mistura é formada pela associação de duas ou mais substâncias puras (chamadas de componentes). A grande divisão ocorre justamente na aparência e nas propriedades físicas dessa associação.
Uma mistura homogênea é aquela que apresenta uma única fase visualmente identificável. Mas o que isso significa na prática?
A palavra “homogêneo” vem do grego (homos = mesmo, genos = tipo) e significa “da mesma natureza”. Em outras palavras, em qualquer porção da mistura que você analisar, as propriedades serão idênticas e os componentes estarão distribuídos de maneira uniforme.
Por conseguinte, você não consegue distinguir, a olho nu ou com o uso de instrumentos comuns (como um microscópio óptico), onde termina um componente e começa outro.
Um exemplo clássico e facilmente compreensível é o soro caseiro ou água com sal (cloreto de sódio). Ao dissolver o sal na água e mexer bem, você obtém um líquido perfeitamente transparente e uniforme. Não é possível ver os cristais de sal flutuando. Em qualquer gota desse líquido, a proporção de sal e água será a mesma.
Esse é o cerne da homogeneidade: a uniformidade na composição e nas propriedades em toda a extensão do sistema.
Outra característica marcante é que essas misturas são estáveis, ou seja, seus componentes não se separam espontaneamente com o tempo, a menos que uma condição externa (como evaporação) seja aplicada.
A água do mar, como se pode ver na imagem abaixo, é uma solução aquosa homogênea que contém diversos sais dissolvidos.

Entender a teoria é essencial, mas conectá-la ao mundo real fixa o aprendizado. As misturas homogêneas, também chamadas de soluções, estão por toda parte. Vamos listar e detalhar algumas das principais, indo além do óbvio.
Seguem cinco exemplos de misturas homogêneas comumente citadas em aplicações ou como substâncias úteis:
Outros exemplos cotidianos incluem: suco de laranja coado (sem a polpa), café coado, soro fisiológico (NaCl 0,9% em água), refrigerantes (gás carbônico dissolvido em água açucarada) e perfumes (essências dissolvidas em álcool).
Agora que está claro o que é uma mistura homogênea, o contraste com as misturas heterogêneas se torna praticamente evidente.
De se ver, portanto, que, enquanto a homogeneidade fala de uniformidade, heterogêneo (heteros = diferente) refere-se à diversidade, à presença de mais de uma fase.
Logo, em uma mistura heterogênea, você pode distinguir visualmente os componentes, pois eles formam duas ou mais fases distintas. Essas fases podem ser separadas por métodos físicos simples, como a filtração ou a decantação.
A composição, por conseguinte, não é uniforme. Dessa forma, uma amostra retirada de um ponto pode ser completamente diferente de uma amostra retirada de outro.
Na imagem abaixo pode-se ver óleo na superfície do mar, um exemplo de uma mistura heterogênea. As diferentes fases da mistura são perfeitamente distinguíveis.

Para ajudar na fixação do aprendizado, elencamos, na tabela abaixo, as diferentes características entre uma mistura homogênea e uma mistura heterogênea.
| Característica | Mistura homogênea | Mistura heterogênea |
|---|---|---|
| Número de fases | Uma única fase. | Duas ou mais fases. |
| Aspecto visual | Uniforme em toda sua extensão. | Não uniforme, com divisões visíveis. |
| Distinção dos componentes | Impossível a olho nu ou com microscópio comum. | Possível a olho nu ou com instrumentos simples. |
| Exemplos comuns | Ar, água com sal, gasolina, aço. | Água e óleo, granito, sangue total (não centrifugado), pizza, sal e areia. |
| Separação | Requer métodos mais complexos (destilação, osmose reversa). | Separada por métodos geralmente simples (filtração, decantação, peneiração). |
| Estabilidade | Geralmente estáveis (os componentes não se separam sozinhos). | Muitas vezes instáveis (os componentes podem se separar por densidade). |
Vimos acima exemplos de misturas homogêneas. Hora de partirmos para exemplos de misturas heterogêneas.
Seguem, pois, também cinco exemplos de misturas heterogêneas para melhor fixação e compreensão das diferenças quando comparadas com as misturas homogêneas.
Entre o mundo homogêneo e o heterogêneo, existe uma categoria especial: os coloides ou dispersões coloidais.
Eles são um verdadeiro “quase isso, quase aquilo” e costumam gerar dúvidas. Um coloide, como o leite ou a maionese, parece ser homogêneo a olho nu – você não vê partículas separadas.
No entanto, se usar um microscópio poderoso, perceberá que há partículas de um componente dispersas no outro, mas essas partículas são maiores do que as de uma solução verdadeira (como sal na água) e menores do que as de uma suspensão grosseira (como areia na água).
Essas partículas coloidais são grandes o suficiente para espalhar a luz – é o famoso efeito Tyndall, que é a maneira prática de identificar um coloide. Pense no feixe de luz visível ao passar pelos copos de uma névoa ou no feixe de um projetor em uma sala com partículas de poeira no ar. Soluções verdadeiras (homogêneas) não apresentam esse efeito.
Apesar da aparência uniforme, portanto, os coloides são, na classificação mais rigorosa, misturas heterogêneas bifásicas. Eis aí, pois, um ponto de atenção para questões mais capciosas!
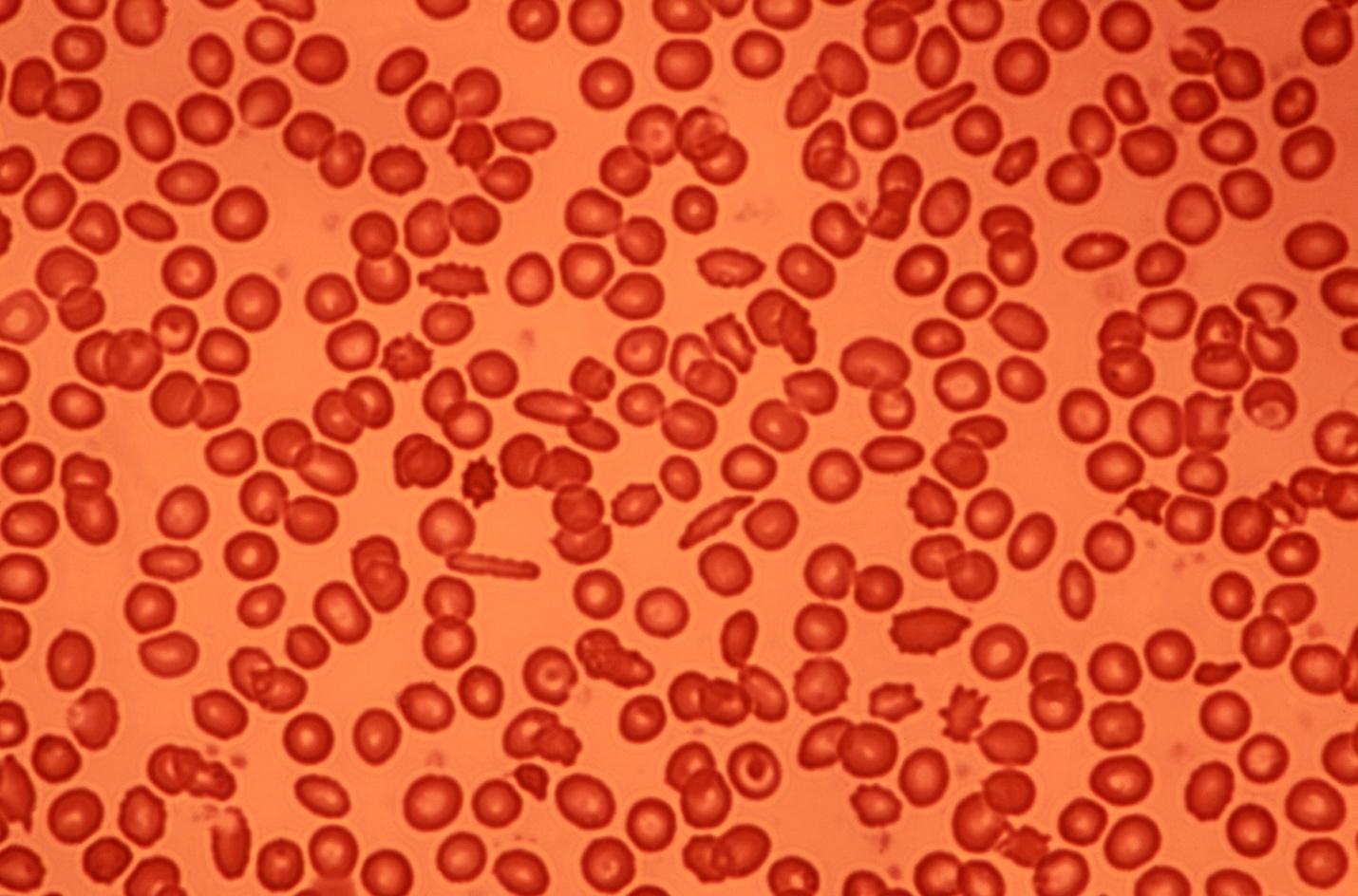
A imagem a seguir são células sanguíneas em visão microscópica. O sangue, portanto, é um colóide.
Separar os componentes de uma mistura homogênea é um desafio maior, justamente devido à intimidade entre eles. Não basta um filtro ou uma peneira.
É necessário explorar alguma propriedade física diferente entre os componentes, como o ponto de ebulição ou a solubilidade. Vamos explorar os principais métodos:
Já na osmose reversa é aplica uma pressão externa maior do que a pressão osmótica, forçando o solvente puro a passar pela membrana, deixando os sais e impurezas para trás.
A osmose reversa é a tecnologia central utilizada nas estações de dessalinização de água do mar. Uma questão relevante, portanto, quando o assunto é sustentabilidade.
O Enem e os vestibulares tradicionais (Fuvest, Unicamp, Unesp, etc.) não cobram esse tópico de forma isolada e decorada, como é comum nas diferentes áreas de conhecimento cobradas nas provas.
Por consequência, eles contextualizam o tópico misturas homogêneas. Em razão disso, você pode encontrar questões que:
Para fomentar seus estudos de forma metódica, apresentamos abaixo um infográfico que indica o caminho a seguir para ajudar você a fixar a matéria.

Para melhor fixação e exemplificação, apresentamos abaixo duas questões sobre como o assunto pode ser cobrado tanto no Enem quanto em um vestibular.
O processo de dessalinização da água do mar é uma alternativa para regiões com escassez de água potável. Esse processo pode ser realizado por destilação simples ou por osmose reversa. Em relação a esses processos, é correto afirmar que:
a) A destilação simples separa os componentes da água do mar explorando diferenças de densidade.
b) A osmose reversa é um processo espontâneo que não requer aporte de energia.
c) Tanto a destilação simples quanto a osmose reversa são métodos de separação de misturas homogêneas.
d) A água do mar é uma mistura heterogênea, o que facilita sua separação por filtração.
e) A osmose reversa consiste na passagem da água dos sais para a água pura através da membrana.
Resolução comentada:
Um estudante possui um recipiente contendo uma mistura de água (H₂O) e acetona (C₃H₆O), dois líquidos miscíveis. Para separá-los, o método mais adequado é:
a) Filtração.
b) Decantação.
c) Destilação fracionada.
d) Dissolução fracionada.
e) Levigação.
Resolução comentada: Como se trata de uma mistura homogênea de dois líquidos miscíveis, métodos como filtração e decantação (para heterogêneas) são inúteis. O método clássico para separar líquidos miscíveis com pontos de ebulição diferentes (água: 100°C; acetona: ~56°C) é a destilação fracionada, conforme visto acima.
Alternativa correta: letra c.
O caminho para a proficiência passa por três etapas:
Para otimizar esse processo e ter um guia completo, desde a base até as questões mais complexas, contar com um recurso estruturado faz uma diferença enorme na sua jornada. Leve, pois, a sua preparação para um nível de ponta.
O Curso do Professor Ferretto é reconhecido por transformar a forma como os estudantes entendem e dominam a Ciências da Natureza.
Com uma metodologia que prioriza a clareza, a profundidade e a conexão direta com as provas, oferecemos o caminho mais eficiente para você conquistar a nota dos seus sonhos.
O quadro abaixo retrata as razões pelas quais o Curso do Professor Ferretto faz toda a diferença para conseguir a sonhada aprovação no Enem ou vestibular.

🚀 Quer ir além? Não perca mais tempo reunindo material fragmentado. Comece hoje mesmo a estudar com quem entende do assunto.
No Professor Ferretto, você encontra um curso completo focado 100% no Enem e vestibulares. Aprenda com a metodologia que já aprovou milhares de estudantes em todo o Brasil.
👉 Acesse nosso curso gratuito e experimente a metodologia
👉 Quer se preparar com as orientações completas do conteúdo para o Enem? Garanta seu acesso!
Portanto, dominar o conceito de misturas homogêneas vai muito além de memorizar que “água com sal” é um exemplo. É compreender um princípio da natureza – a uniformidade – e suas implicações tecnológicas e ambientais, desde a produção do aço até a dessalinização da água do mar por osmose reversa.
Esse conhecimento é a base para avançar em tópicos mais complexos da Química e, sem dúvida, um requisito para um bom desempenho nas provas mais importantes do país.
Ao conectar a teoria com aplicações práticas, diferenciar com clareza os tipos de misturas e entender os métodos para manipulá-las, você não está apenas estudando para uma prova; está desenvolvendo uma visão científica do mundo ao seu redor.
Siga, portanto, as dicas, pratique com as questões e busque os melhores recursos. Sua aprovação é o próximo passo lógico nessa jornada de aprendizado.

