
Assuntos de química que mais caem no Enem estão entre as principais dúvidas de quem estuda para a prova de...

A água é um componente essencial dos organismos vivos, constituindo entre 60% a 70% do corpo humano e cobrindo 70% da superfície terrestre. Esta importância está relacionada às suas propriedades físico-químicas únicas, que são cruciais para a vida. Estes aspectos são frequentemente abordados nas provas do Enem e vestibulares, considerando sua relevância em Química, Física e Biologia. O artigo explora a estrutura molecular da água, suas propriedades principais como coesão, adesão, alto calor específico, densidade anômala, entre outras, todas ligadas à formação de pontes de hidrogênio. O conhecimento dessas propriedades não só ajuda na compreensão de fenômenos ambientais e biológicos como também é vital para resolver questões interdisciplinares nos exames. A água é destacada como um solvente universal, regulador térmico, e sua peculiar densidade explica fenômenos como o gelo flutuando em lagos, preservando a vida no inverno. Estudar essas propriedades proporciona ao estudante uma sólida base para enfrentar questões no Enem, que frequentemente contextualizam conhecimentos teóricos em situações práticas e cotidianas.
A água é o principal constituinte dos organismos vivos. Cerca de 60% a 70% do corpo humano é constituído por água. A vida talvez tenha surgido aqui na Terra justamente pela abundância da água, 70% da superfície do nosso planeta é recoberta pela água.
Sua importância, no entanto, vai muito além da quantidade. São as características físico-químicas únicas desta molécula que permitem a existência da vida como a conhecemos.
As propriedades da água, portanto, são um tema interdisciplinar, que unem a Química, a Física e a Biologia, por isso, são presença garantida nas provas do Enem e nos principais vestibulares do país.
Neste artigo, exploraremos a fundo a estrutura, as principais propriedades e as funções e as anomalias dessa substância vital, com uma linguagem clara e objetiva para impulsionar sua preparação.
Continue a leitura e confira!
Toda a singularidade da água começa em sua escala mais íntima: a molecular. Sua conhecida fórmula, H₂O, indica uma composição aparentemente simples – dois átomos de hidrogênio ligados a um de oxigênio. No entanto, é a disposição espacial desses átomos que define seu comportamento.
A molécula de água possui uma geometria molecular angular, semelhante a um “V”, com um ângulo de aproximadamente 104,5° entre as ligações. Essa forma não é acidental, visto que resulta da repulsão entre os dois pares de elétrons não ligantes do átomo de oxigênio, que ocupam mais espaço e comprimem as ligações O-H.
A ligação que une o oxigênio ao hidrogênio é uma ligação covalente polar. E o que significa isso? Significa que o oxigênio, por ser muito mais eletronegativo, atrai os elétrons compartilhados com maior força.
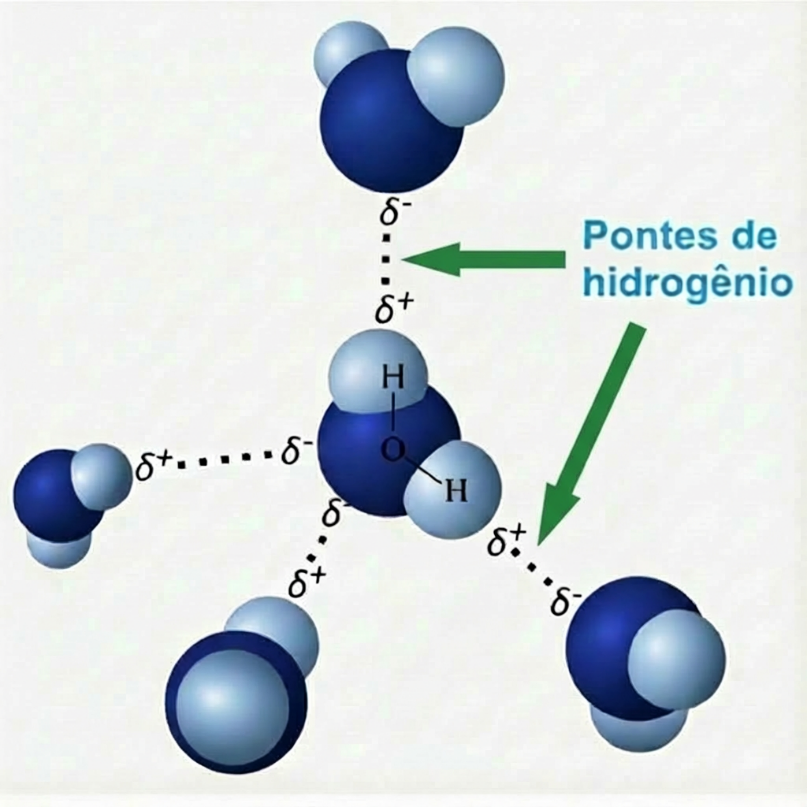
Esse movimento gera uma distribuição de carga desigual: a região do oxigênio adquire uma carga parcial negativa (δ-), enquanto cada hidrogênio fica com uma carga parcial positiva (δ+). Consequentemente, a molécula de água se torna um dipolo permanente, um pequeno ímã com pólos definidos.
É essa polaridade que abre caminho para a interação mais crucial: a formação de pontes de hidrogênio. Uma ponte de hidrogênio é uma atração intermolecular forte (se comparada a outras como as de Van der Waals) entre o hidrogênio δ+ de uma molécula e o oxigênio δ- de uma molécula vizinha.
Cada molécula de água pode se ligar a até quatro outras através dessas pontes, criando uma rede tridimensional dinâmica e coesa.
Por esse motivo, as pontes de hidrogênio são, em última análise, as grandes responsáveis pelo conjunto único de propriedades da água. Elas “prendem” as moléculas com mais força, exigindo mais energia para separá-las, o que impacta diretamente pontos de fusão e ebulição, capacidade térmica e muito mais.
Portanto, antes de listar quais são as propriedades da água, é fundamental internalizar que sua estrutura polar e as pontes de hidrogênio são a chave explicativa para todas elas.
Segue ilustração das pontes de hidrogênio entre as moléculas de água.
Agora podemos explorar as propriedades da água química que a tornam uma substância extraordinária e indispensável para a vida.
Estas propriedades são frequentemente cobradas de forma aplicada, por isso, além de defini-las, traremos exemplos práticos que ilustram sua importância no mundo real e no nosso organismo.
A coesão refere-se à atração entre moléculas da mesma substância. Na água, as pontes de hidrogênio promovem uma forte coesão, mantendo-a “unida”.
Já a adesão é a atração entre moléculas diferentes; a água adere facilmente a superfícies polares ou carregadas.
A combinação dessas duas forças resulta na capilaridade, a capacidade de a água subir por tubos extremamente finos (capilares) contra a força da gravidade.
Esse fenômeno é vital para a sobrevivência das plantas, permitindo que a água do solo seja transportada através do xilema até as folhas mais altas.
O calor específico é a quantidade de energia necessária para elevar em 1°C a temperatura de 1g de uma substância.
A água possui um calor específico excepcionalmente alto. Isso ocorre porque a energia fornecida é inicialmente usada para romper as pontes de hidrogênio, e só depois acelera o movimento das moléculas (aumentando a temperatura).
Na prática, essa propriedade faz dos oceanos, dos grandes lagos e dos rios reguladores climáticos, absorvendo e liberando calor lentamente e amainando variações térmicas nas regiões costeiras. Em nosso corpo, ela ajuda a manter a temperatura interna estável.
Para que a água passe do estado líquido para o gasoso, é necessário fornecer uma quantidade de energia muito grande – seu calor de vaporização é elevado. Essa propriedade, em consequência, é um mecanismo de resfriamento extremamente eficiente.
Por essa razão, quando o suor evapora da nossa pele, ele retira uma grande quantidade de calor do corpo, proporcionando o resfriamento.
A maioria das substâncias é mais densa no estado sólido. A água, porém, apresenta uma densidade máxima a 4°C, e o gelo (sólido) é menos denso que a água líquida.
Durante o congelamento, as moléculas se organizam em uma estrutura cristalina hexagonal aberta, estabilizada por pontes de hidrogênio, que ocupa mais espaço. Por isso, o gelo flutua.
Essa é uma das propriedades exclusivas da água com profundo impacto ecológico: a camada de gelo superficial funciona como um isolante térmico da água líquida abaixo, preservando a vida aquática durante invernos rigorosos.
Abaixo uma imagem de um peixe dentro de um lago cuja superfície congelou.

A tensão superficial é a resistência da superfície de um líquido à ruptura, criando uma “película” aparente. Ela resulta da forte coesão entre as moléculas de água na interface ar-líquido, que estão sendo puxadas para os lados e para baixo pelas outras moléculas, mas não para cima.
É por causa da tensão superficial que insetos como os hemípteros (barqueiros) conseguem andar sobre a água, ou que uma lâmina de barbear pode flutuar se colocada com cuidado sobre a água.
Nos alvéolos pulmonares, um surfactante (substância lipoproteica produzida nos pulmões) reduz a tensão superficial, permitindo a expansão pulmonar.
Devido à sua alta polaridade, a água é um excelente solvente para sais e substâncias iônicas ou polares. Suas moléculas se agrupam ao redor dos íons (processo de hidratação), neutralizando suas cargas e separando-os da rede cristalina.
Por isso, a água é o meio onde ocorre a maioria das reações químicas nos seres vivos, transportando nutrientes e resíduos através do sangue e da seiva.
É importante notar que substâncias apolares, como lipídios, não se dissolvem em água – fato explorado na estrutura das membranas celulares.
Embora mais comum em questões de Física, o ponto triplo é uma propriedade termodinâmica crucial. É a condição única de temperatura e pressão na qual a substância coexiste em equilíbrio nos três estados físicos: sólido, líquido e gasoso.
Para a água, isso ocorre a 0,01°C e 4,58 mmHg (pressão muito baixa). Esse ponto é uma referência fundamental na calibração de instrumentos e na definição da escala Kelvin.
A água (H2O) é quimicamente fascinante porque se comporta de maneira diferente de quase qualquer outro líquido conhecido.
Embora ela possua várias características anômalas, existem três propriedades principais que são frequentemente citadas (mas não há consenso) como as mais distintas e vitais para a existência da vida na Terra.
A raiz de quase todas essas “esquisitices” da água está nas ligações de hidrogênio (a atração entre o átomo de oxigênio ligeiramente negativo de uma molécula de água e o hidrogênio ligeiramente positivo de outra).
Aqui estão as três propriedades exclusivas da água que mais se destacam:
Na grande maioria das substâncias, a forma sólida é mais densa que a forma líquida (os átomos se compactam mais). Com a água, acontece o inverso.
Quando a água congela, as ligações de hidrogênio formam uma estrutura cristalina hexagonal (como uma rede) que mantém as moléculas mais afastadas umas das outras do que quando estão no estado líquido.
Como o gelo é cerca de 9% menos denso que a água líquida, ele acaba flutuando. E aqui cabe uma observação muito peculiar dessa anomalia. Se o gelo afundasse, lagos e oceanos congelariam de baixo para cima, matando a vida aquática.
Como flutua, o gelo forma uma camada isolante na superfície, mantendo a água líquida por baixo habitável para as espécies aquáticas durante o inverno, conforme já visto acima.
A água tem uma capacidade incrivelmente alta de absorver e reter calor sem que sua própria temperatura suba drasticamente.
Para aumentar a temperatura da água, é preciso primeiro romper muitas ligações de hidrogênio antes que as moléculas possam começar a se mover mais rápido (o que percebemos como calor). Isso requer muita energia.
É por isso que a areia da praia queima seus pés (baixo calor específico, esquenta rápido), mas a água do mar continua fresca.
Isso é de grande importância para o controle do clima. Por quê? Porque os oceanos absorvem o calor do sol durante o dia e o liberam lentamente à noite, estabilizando a temperatura global.
Além disso, como somos feitos majoritariamente de água, isso nos ajuda a manter a temperatura corporal estável (algo em torno de 36,5°C), independentemente das mudanças bruscas de temperatura no ambiente.
Frequentemente chamada de “solvente universal”, a água dissolve mais substâncias do que qualquer outro líquido.
A molécula de água é polar. Ela tem um lado positivo (hidrogênios) e um lado negativo (oxigênio). Isso a transforma em um ímã molecular extremamente potente.
Por isso, a água consegue envolver átomos de outras substâncias (como o sal), separando-os e mantendo-os em solução.
Isso é de extrema importância, pois a água é o meio de transporte da natureza. O sangue (principalmente água) transporta oxigênio e nutrientes dissolvidos para as células e remove resíduos dissolvidos dos tecidos. Sem essa propriedade, as reações químicas da vida iriam parar.
Muitos se perguntam quais seriam as propriedades fundamentais da água. Importante notar que esse tipo de questionamento está diretamente ligado com o que já foi respondido, isto é, “quais as principais propriedades da água? Por conseguinte, não se irá descrever novamente essas propriedades.
Ainda assim, conste-se que são descritas como propriedades fundamentais da água as seguintes: solvente universal, alta tensão superficial, capilaridade (coesão/adesão), elevados calores específico e de vaporização, densidade anômala e termorreguladora.
Como essas propriedades foram tratadas isoladamente acima, é desnecessário discorrer novamente sobre cada uma delas.
A imagem a seguir mostra um inseto patinador, também conhecidos como barqueiros, sobre a água graças à tensão superficial da água.

As 4 funções principais da água estão mais relacionadas ao contexto biológico, não necessariamente à química em si, senão vejamos.
A água, como já vimos, é um solvente e meio de transporte tanto no sangue de animais quanto na seiva das plantas.
A segunda função principal da água, sob o aspecto da biologia, é que ela é um regulador térmico, tanto de organismos vivos quanto do próprio planeta.
A água também é de extrema importância como reagente bioquímico como as que ocorrem da fotossíntese e hidrólises.
Por último, a água tem função estruturante e de suporte (turgescência celular, flutuação do gelo que cria habitats).
O estudo das propriedades da água é tão valorizado pelos examinadores justamente por seu caráter interdisciplinar. Uma única questão pode, de forma elegante, integrar conhecimentos de:
No Enem, a abordagem é quase sempre contextualizada. O texto de apoio pode discorrer sobre um fenômeno ambiental (como a moderação do clima costeiro), um fato do cotidiano (o resfriamento pelo suor) ou uma questão tecnológica (mecanismos de dessalinização).
A pergunta, no núcleo, exige que o aluno identifique qual propriedade da água está em jogo e compreenda sua causa e consequência. A prova avalia a competência de relacionar o conhecimento teórico com aplicações práticas.
Nos vestibulares tradicionais, (como Fuvest, Unicamp, Unesp, etc.), as questões podem ser mais diretas e conceituais.
É comum encontrar itens que pedem para explicar, com base nas pontes de hidrogênio, por que a água tem ponto de ebulição anormalmente alto, ou discursivas que exigem a relação entre a polaridade e a função de solvente universal nos sistemas biológicos.
(ENEM – Adaptada) Imagine uma gota de óleo na superfície de um pequeno lado, não longe dali, um inseto parece patinar sobre a água. Esses dois fenômenos estão relacionados, respectivamente, a quais propriedades físicas da água?
a) Viscosidade e densidade.
b) Densidade e tensão superficial.
c) Coesão e adesão.
d) Solubilidade e capilaridade.
e) Condutividade térmica e calor específico.
Gabarito: B. A gota de óleo fica na superfície devido à densidade (ela é menos densa que a água). O inseto se sustenta devido à tensão superficial. Questão típica que testa a aplicação das propriedades da água.
(Pism – UFJF) A maior parte dos seres vivos é constituída por água, responsável por 70 a 85% de sua massa. Considere as afirmativas abaixo relacionadas às propriedades físico-químicas da água.
I) A molécula de água é polarizada, ou seja, apesar de ter carga elétrica total igual a zero, possui carga elétrica parcial negativa na região do oxigênio e carga elétrica parcial positiva na região de cada hidrogênio.
II) Na água em estado líquido, a atração entre moléculas vizinhas cria uma espécie de rede fluida, em contínuo rearranjo, com pontes de hidrogênio se formando e se rompendo a todo momento.
III) A tensão superficial está presente nas gotas de água, sendo responsável pela forma peculiar que elas possuem.
IV) O calor específico é definido como a quantidade de calor absorvida durante a vaporização de uma substância em seu ponto de ebulição.
Resolução: Vimos acima que o hidrogênio tem carga parcial positiva e o oxigênio carga parcial negativa, formando um pequeno ímã com dois polos, logo a molécula de água é polarizada. Correto o item I, portanto.
Como consta acima, as pontes de hidrogênio criam uma rede tridimensional e coesa. Logo, a afirmativa II está correta.
Acima foi explicado que a tensão superficial é a resistência da superfície de um líquido à ruptura. Assim, uma gota de água costuma ter uma forma ligeiramente esférica justamente pela propriedade da tensão superficial. Por conseguinte, correto o item III.
Como visto, o calor específico é a quantidade de energia necessária para elevar em 1°C a temperatura de 1g de uma substância. Não é, pois, o que consta no item IV. Consequentemente, o item IV está incorreto.
Conclui-se, pois, que a alternativa correta é a letra C.
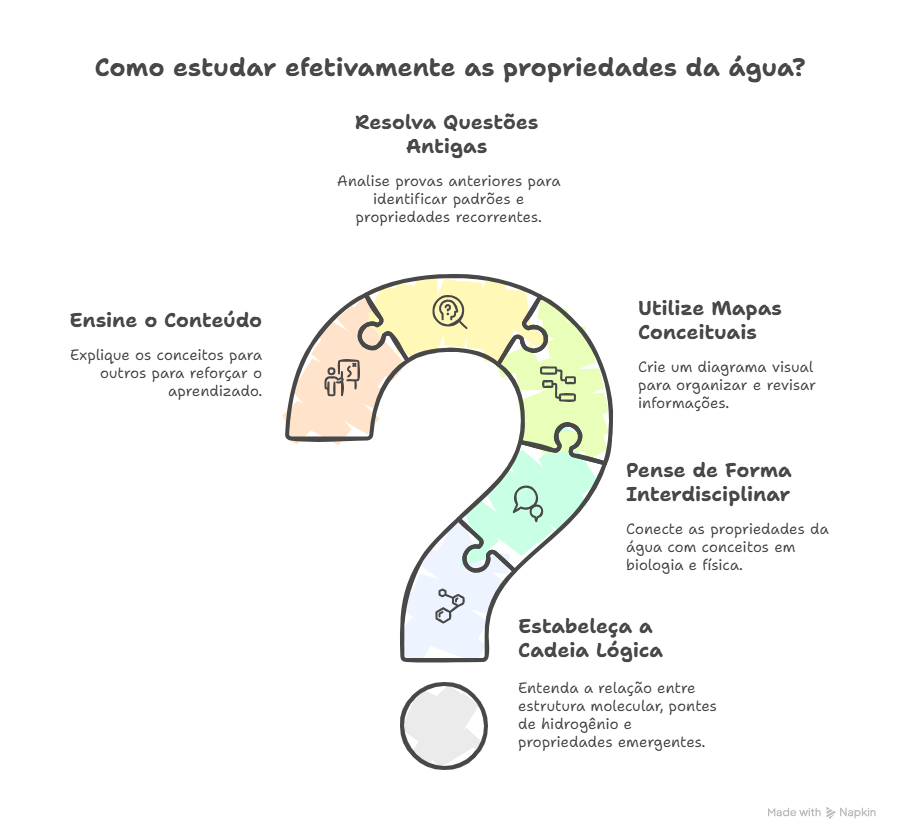
A jornada rumo à aprovação no Enem e nos vestibulares exige mais do que conhecer os conteúdos; é preciso saber como estudá-los de forma estratégica e eficiente. É aí que a metodologia certa faz toda a diferença.
O Professor Ferretto construiu uma plataforma de ensino que vai te guiar por todo o percurso, incluindo o domínio total sobre as propriedades da água e todos os outros temas cruciais.
Imagine ter acesso a vídeo aulas didáticas e objetivas, que explicam conceitos complexos de forma simples, acompanhadas de exercícios comentados e um plano de estudos personalizado que se adapta às suas necessidades e ao seu tempo. Tudo isso está disponível no Curso Enem do Professor Ferretto, uma solução completa para sua preparação.
E o melhor: você pode começar a transformar seus estudos hoje mesmo, sem custo algum! O Professor Ferretto oferece um curso gratuito robusto, com material de alta qualidade, para você experimentar a metodologia e sentir na prática como é possível evoluir com foco e organização.
Não deixe que dúvidas sobre pontes de hidrogênio, calor específico ou qualquer outro conceito atrapalhem seu caminho para a universidade. Invista na sua preparação com quem tem um método comprovado.
👉 Quer dominar as Propriedades da Água e todos os outros tópicos de Química do Enem?
Acesse agora o Curso Gratuito do Professor Ferretto e veja como a preparação pode ser direta e eficiente.
👉 E para uma preparação completa, com planos de estudo, monitorias e todo o suporte para mandar bem no Enem, conheça o ENEM ANATOMY.
Dominar as propriedades da água é, definitivamente, um dos investimentos mais inteligentes que um candidato ao Enem e aos vestibulares pode fazer.
Como vimos ao longo deste artigo, esse tema transcende a simples memorização de características; ele exige e desenvolve a capacidade de raciocinar de forma interdisciplinar, conectando a microescala das ligações químicas à macroescala dos fenômenos biológicos e ambientais.
As propriedades da água – desde a tensão superficial que permite a um inseto caminhar até a densidade anômala que preserva ecossistemas aquáticos – são exemplos perfeitos de como a ciência explica o mundo ao nosso redor.
Ao internalizar essas relações de causa e efeito, você estará apto a decifrar não apenas as questões específicas sobre a água, mas também a aplicar esse modelo de pensamento a outros conteúdos.
Utilize, portanto, as dicas apresentadas, pratique com exercícios e, se sentir necessidade, busque uma estrutura de estudos que otimize seu tempo e potencial, como a oferecida pelo Professor Ferretto.
Entender profundamente as propriedades da água é mais do que aprender Química; é construir uma base sólida para a sua aprovação.

