
Assuntos de quûÙmica que mais caem no Enem estûÈo entre as principais dû¤vidas de quem estuda para a prova de...
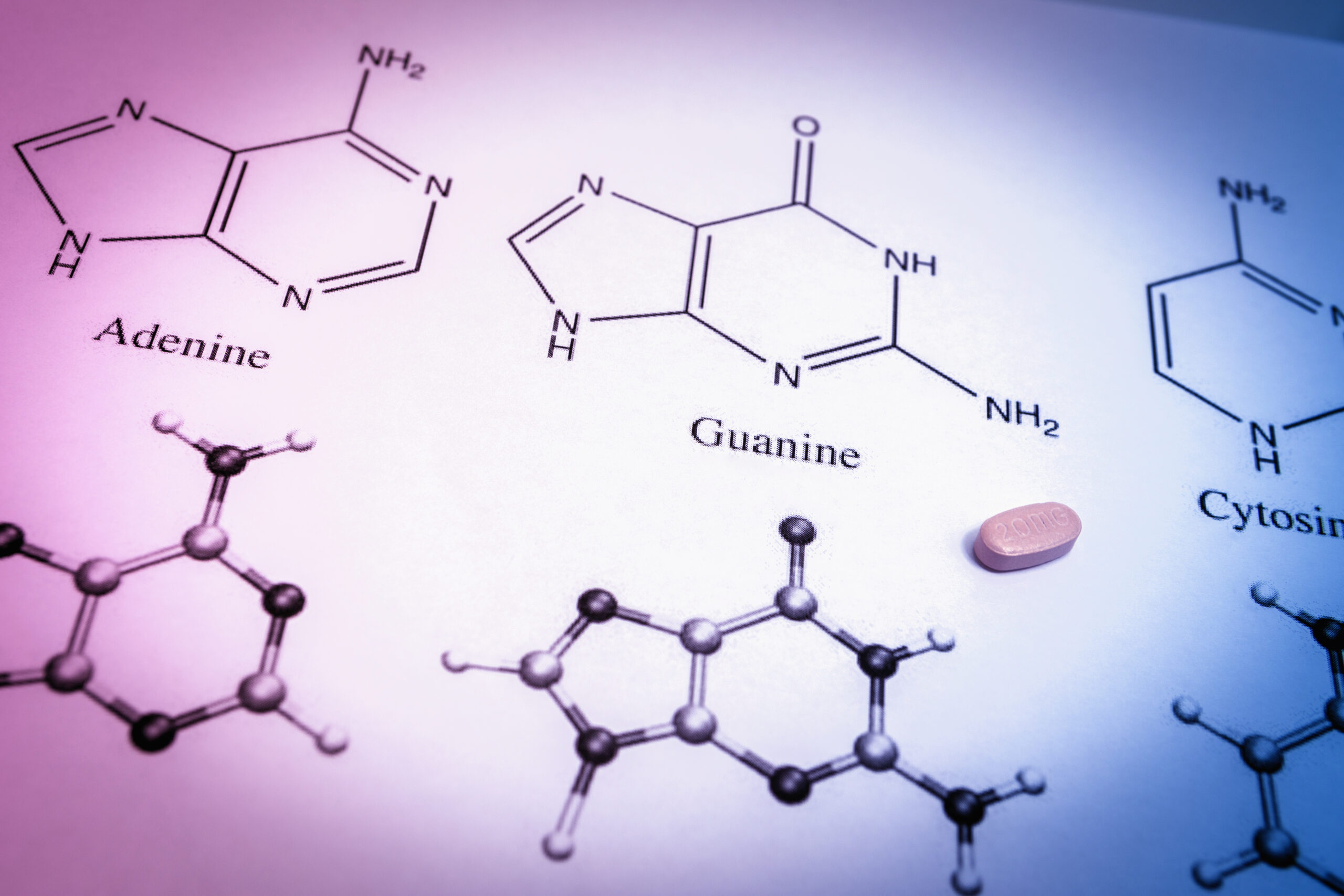
FunûÏûçes orgûÂnicas representam um dos tû°picos essenciais em quûÙmica para estudantes que estûÈo se preparando para o ENEM e outros vestibulares. O entendimento claro de suas caracterûÙsticas, nomenclaturas e reaûÏûçes ûˋ vital para resolver questûçes com eficiûˆncia e conquistar notas altas na prova. Este guia completo visa ajudar os alunos a dominarem as funûÏûçes orgûÂnicas, oferecendo dicas prûÀticas e recursos para estudo aprofundado.
QuûÙmica OrgûÂnica estuda os compostos baseados no elemento carbono. Essa versatilidade û¤nica do carbono em formar longas cadeias e se ligar a diversos outros elementos dûÀ origem a uma infinidade de compostos.
NûÈo por menos, a quûÙmica orgûÂnica ûˋ tida como a linguagem da vida e da tecnologia.
Para organizar esse universo de compostos, substûÂncias com propriedades quûÙmicas semelhantes foram agrupadas emô FunûÏûçes OrgûÂnicas, por possuûÙrem um ûÀtomo ou conjunto de ûÀtomos especûÙfico de ûÀtomos em sua composiûÏûÈo, chamados de grupos funcionais.
A partir dessa identificaûÏûÈo, ûˋ possûÙvel classificar a substûÂncia (como ûÀlcool, cetona ou ûÀcido), prever suas propriedades e entender suas aplicaûÏûçes no cotidiano, da energia dos combustûÙveis aos aromas dos alimentos.
Este guia oferece um panorama completo, com as principais funûÏûçes, nomenclatura, dicas de estudo e como esse conhecimento ûˋ cobrado nas provas, transformando teoria em acerto na sua avaliaûÏûÈo.
FunûÏûçes orgûÂnicas sûÈo grupos de compostos orgûÂnicos que possuemô propriedades quûÙmicas semelhantes, devido û presenûÏa de umô ûÀtomo ou grupo de ûÀtomosô caracterûÙstico em suas estruturas que determina suas propriedades quûÙmicas e reatividade.
Esse grupo caracterûÙstico ûˋ chamado deô Grupo Funcional. û ele, portanto, o verdadeiro responsûÀvel pela reatividade e pelo comportamento quûÙmico da molûˋcula. Logo, identificar o grupo funcional em uma fû°rmula estrutural ûˋ o primeiro e mais crucial passo para classificar o composto.
Por exemplo, saber que uma substûÂncia possui o grupoô -OHô (oxigûˆnio e hidrogûˆnio) ligado a carbono saturado (nûÈo aromûÀtico) imediatamente a classifica como umô ûÀlcoolô e nos dûÀ pistas sobre sua polaridade, capacidade de formar ligaûÏûçes de hidrogûˆnio e, atûˋ mesmo, sobre propriedades fûÙsicas como ponto de ebuliûÏûÈo, que estûÀ intrinsecamente ligada a conceitos de troca de energia, como aô capacidade tûˋrmicaô e oô calor especûÙficoô do meio onde se encontra.
Abaixo, apresentamos uma tabela bastante completa das principaisô funûÏûçes orgûÂnicas, seus grupos funcionais, fû°rmulas gerais e um exemplo de cada uma. Esta ûˋ uma ferramenta de consulta rûÀpida e essencial para seus estudos preparatû°rios para o Enem e vestibulares.
| FunûÏûÈo OrgûÂnica | Grupo Funcional (Estrutura) | Fû°rmula Geral | Exemplo (Nome e Fû°rmula) |
|---|---|---|---|
| Hidrocarboneto (Alcano) | Apenas C e H; ligaûÏûçes simples | CãHãããã (n ãË 1) | Etano:ô HãCãCHã |
| Hidrocarboneto (Alceno) | LigaûÏûÈo dupla entre carbonos (C=C) | CãHãã (n ãË 2) | Eteno (Etileno):ô HãC=CHã |
| Hidrocarboneto (Alcino) | LigaûÏûÈo tripla entre carbonos (CãÀC) | CãHãããã (n ãË 2) | Etino (Acetileno):ô HCãÀCH |
| Hidrocarboneto (AromûÀtico) | Anel benzûˆnico (CãHã) | CãHã (benzono) e derivados | Benzeno:ô CãHã (anel hexagonal) |
| ûlcool | Hidroxila ligada a C saturado (ãOH) | RãOH (R = radical) | Etanol:ô HãCãCHããOH |
| Fenol | Hidroxila ligada a anel aromûÀtico (ãOH) | ArãOH (Ar = aromûÀtico) | Fenol:ô CãHã ãOH |
| ûter | Oxigûˆnio ligado a dois carbonos (CãOãC) | RãOãR’ (R e R’ podem ser iguais ou diferentes) | ûter dimetûÙlico:ô HãCãOãCHã |
| AldeûÙdo | Carbonila na extremidade da cadeia (ãCHO) | RãCHO | Etanal (AcetaldeûÙdo):ô HãCãCHO |
| Cetona | Carbonila no meio da cadeia (C=O) | RãCOãR’ | Propanona (Acetona):ô HãCãCOãCHã |
| ûcido CarboxûÙlico | Carboxila (ãCOOH) | RãCOOH | ûcido etanoico (Acûˋtico):ô HãCãCOOH |
| ûster | ãCOOã (oxigûˆnio entre carbonila e C) | RãCOOãR’ | Acetato de etila:ô HãCãCOOãCHããCHã |
| Amina (PrimûÀria) | Amino (ãNHã) ligado a C | RãNHã | Metilamina:ô HãCãNHã |
| Amina (SecundûÀria) | Amino com dois R (ãNHã) | RãNHãR’ | Dimetilamina:ô HãCãNHãCHã |
| Amina (TerciûÀria) | Amino com trûˆs R (ãNã) | RãNãR” R’ |
Trimetilamina:ô (HãC)ãN |
| Amida | Carbonila ligada a Nitrogûˆnio (ãCONHã) | RãCONHã (primûÀria) | Etanamida:ô HãCãCONHã |
| Haleto OrgûÂnico | Halogûˆnio (F, Cl, Br, I) ligado a C | RãX (X = F, Cl, Br, I) | Clorometano:ô HãCãCl |
| Nitrocomposto | Grupo nitro (ãNOã) ligado a C | RãNOã | Nitrobenzeno:ô CãHã ãNOã |
Note que, conforme a tabela apresentada acima, os compostos orgûÂnicos podem ser classificados de acordo com aô natureza da cadeia carbûÇnicaô (aberta/fechada, saturada/insaturada, etc.) e, principalmente, peloô nû¤mero e tipo de grupos funcionaisô presentes (separado por cores na tabela acima). DaûÙ temos as seguintes funûÏûçes orgûÂnicas:
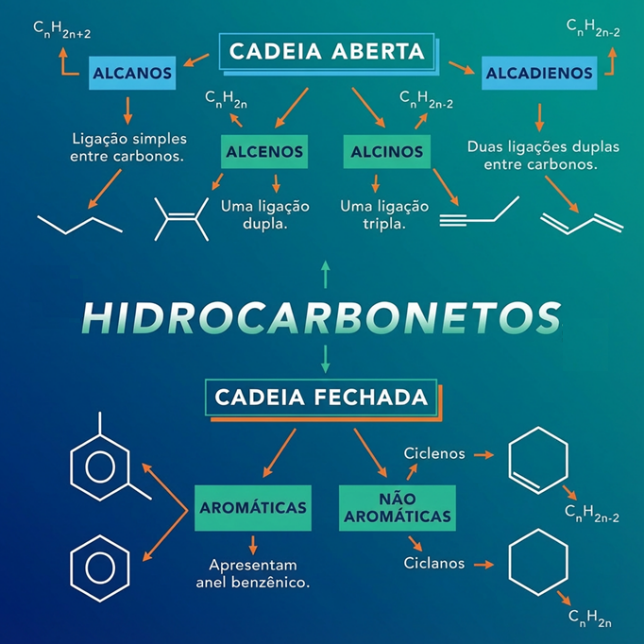
Hidrocarbonetos sûÈo formados unicamente ûÀtomos de carbono (C) e hidrogûˆnio (H). Internamente a funûÏûÈo orgûÂnica dos hidrocarbonetos tem ainda tem as subdivisûçes como: alcanos, alcenos, alcinos, etc. A imagem ilustrativa dos hidrocarbonetos abaixo ajuda na memorizaûÏûÈo.
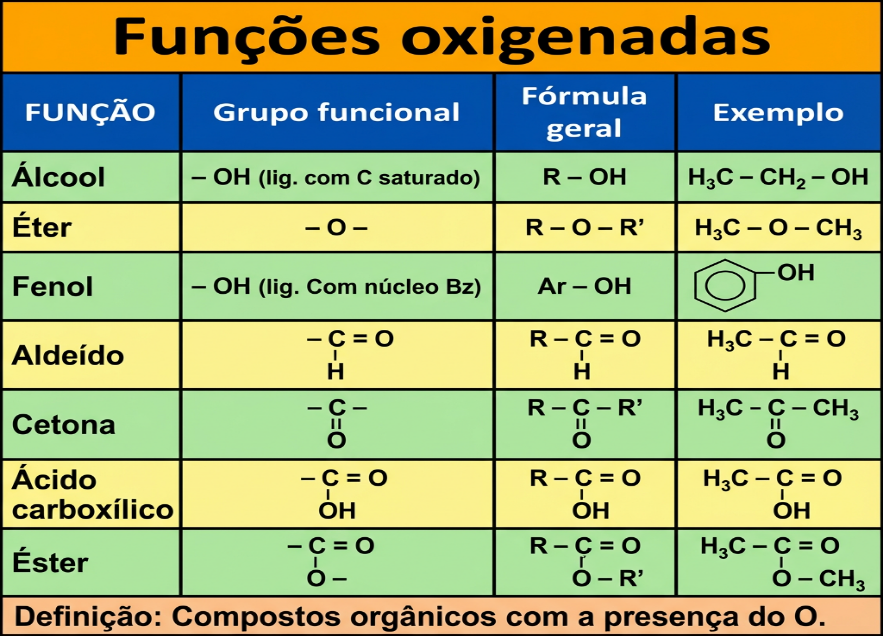
Essas funûÏûçes possuem ûÀtomos de oxigûˆnio no grupo funcional. As principais sûÈo: ûÀlcoois, fenû°is, ûˋteres, aldeûÙdos, cetonas, ûÀcidos carboxûÙlicos e ûˋsteres, de acordo com a imagem a seguir:
As funûÏûçes nitrogenadas possuem ûÀtomos de nitrogûˆnio no grupo funcional. As principais sûÈo as aminas, amidas e nitrilas de acordo com o quadro ilustrativo abaixo.

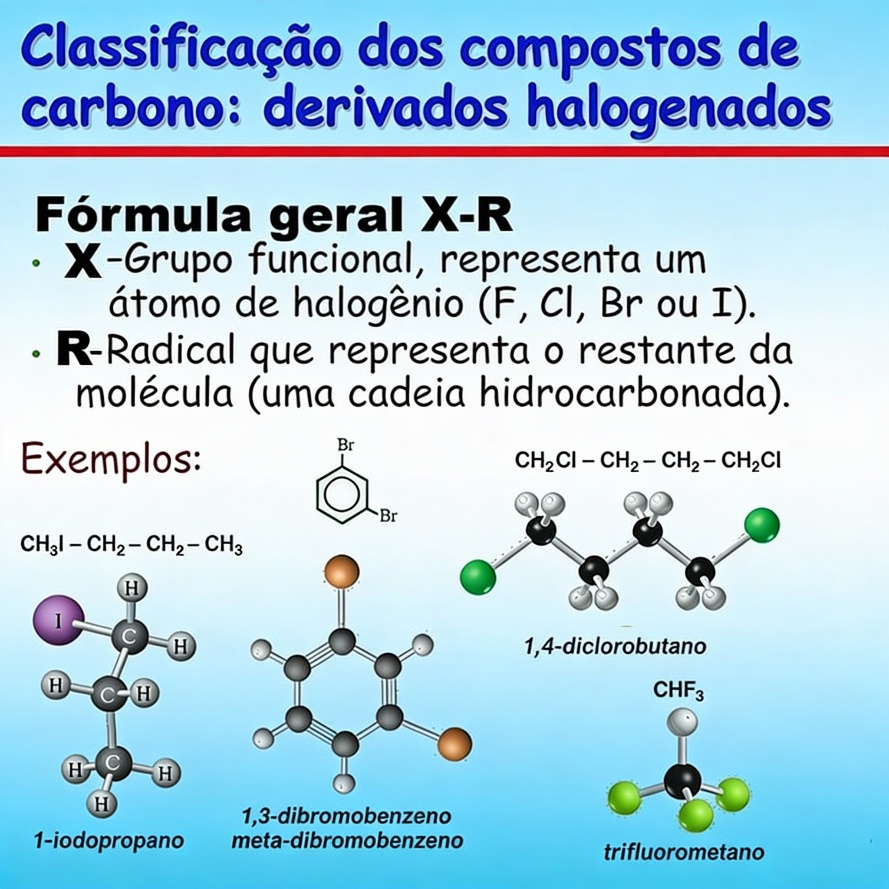
Por fim, as funûÏûçes halogenadas possuem halogûˆnios, elementos nûÈo-metûÀlicos do grupo 17 da tabela periû°dica, ligados û cadeia carbûÇnica. DaûÙ possuûÙrem em sua composiûÏûÈo o flû¤or (F), cloro (Cl) bromo (Br) ou iodo (I) ligados û cadeia carbûÇnica. Como exemplo, cite-se o Clorofû°rmio (CHClã). Abaixo imagem ilustrativo de compostos halogenados.
Importante observar que ûˋ comum que uma molûˋcula apresenteô mais de um grupo funcional. Observe, por exemplo, os aminoûÀcidos (blocos construtores de proteûÙnas), formados de aminas (ãNHã) e um grupo ûÀcido carboxûÙlico (ãCOOH). A fû°rmula geral, portanto, de um aminoûÀcido ûˋ R-CH(NHã)-COOH.
Nesses casos, por conseguinte, essa molûˋcula pertence a mais de uma funûÏûÈo e sua nomenclatura segue uma ordem de prioridade estabelecida pelas regras da UniûÈo Internacional de QuûÙmica Pura e Aplicada ã IUPAC.
Como jûÀ apontado, a nomenclatura oficial (IUPAC) das funûÏûçes orgûÂnicas segue uma lû°gica sistemûÀtica que envolve o nû¤mero de ûÀtomos de carbono, o tipo de ligaûÏûÈo e ainda a funûÏûÈo orgûÂnica principal. Dessa forma, o nome do composto ûˋ construûÙdo da seguinte maneira:
Exemplo PrûÀtico:ô CHã-CHã-CHã-OH
Como visto na parte inicial, a presenûÏa de umô ûÀtomo ou grupo de ûÀtomosô caracterûÙstico em suas estruturas moleculares ûˋ o que determina suas propriedades quûÙmicas e reatividade do composto orgûÂnico.
Cada funûÏûÈo, portanto, confere propriedades especûÙficas, que determinam seus usos. Osô ûÀlcoois, por exemplo, por serem polares e formarem pontes de hidrogûˆnio, sûÈo bons solventes e tûˆm pontos de ebuliûÏûÈo relativamente altos.
JûÀ osô hidrocarbonetosô apolares, como a gasolina, sûÈo combustûÙveis. Osô ûˋsteres, por sua vez,ô sûÈo famosos por seus aromas agradûÀveis, presentes em frutas e essûˆncias artificiais.
û interessante, pois, notar como propriedades fûÙsicas mais amplas, como aô capacidade tûˋrmicaô de uma substûÂncia, interferem em seu comportamento prûÀtico.
Oô calor especûÙfico, que ûˋ a quantidade de calor necessûÀria para elevar a temperatura de 1g de uma substûÂncia em 1ô¯C, ûˋ uma propriedade intensiva crucial dos compostos orgûÂnicos. Lembre-se, uma propriedade intensiva ûˋ a caracterûÙstica fûÙsica ou quûÙmica que nûÈo depende da quantidade (massa ou volume) do material presente.
Aô ûÀgua, solvente universal em muitos processos orgûÂnicos e biolû°gicos, tem umô calor especûÙficoô excepcionalmente alto (1 cal/g.ô¯C). Esse altoô calor especûÙfico da ûÀguaô explica por que ela ûˋ usada em sistemas de refrigeraûÏûÈo e por que ambientes prû°ximos a grandes corpos d’ûÀgua tûˆm clima mais ameno.
Em contraste, muitos solventes orgûÂnicos possuemô calor especûÙficoô menor, aquecendo-se ou resfriando-se mais rapidamente.
Compreender aô fû°rmula do calor especûÙficoô (c = Q/(m.öT)) nûÈo ûˋ foco da OrgûÂnica, mas saber que oô calor especûÙficoô varia entre compostos ajuda a entender fenûÇmenos de transferûˆncia de energia em reaûÏûçes.
NûÈo raro, ao estudar FunûÏûçes OrgûÂnicas, o estudante se depara com certas perguntas relativas ao tema. Algumas nem sempre sûÈo muito precisas, pois surgem de alguma subdivisûÈo e/ou classificaûÏûÈo especûÙfica em funûÏûÈo de alguma aplicabilidade ou interesse pontual.
Ainda assim, para que vocûˆ nûÈo fique na dû¤vida, apresentamos algumas dessas perguntas com suas respectivas respostas:
Embora existam muitos, quatro dos mais essenciais sûÈo:ô Hidroxila (-OH)ô dos ûÀlcoois,ô Carbonila (>C=O)ô de aldeûÙdos e cetonas,ô Carboxila (-COOH)ô dos ûÀcidos, eô Amino (-NHã)ô das aminas.
Podemos pensar em cinco grandesô grupos de funûÏûçes: Hidrocarbonetos, FunûÏûçes Oxigenadas, FunûÏûçes Nitrogenadas, Halogenados e FunûÏûçes OrganometûÀlicas.
Em Biologia, refere-se û sô macromolûˋculasô essenciais û vida: Carboidratos (funûÏûçes ûÀlcool e aldeûÙdo/cetona), LipûÙdios (ûˋsteres, ûÀcidos carboxûÙlicos), ProteûÙnas (amina e ûÀcido carboxûÙlico formando amidas) e ûcidos Nucleicos.
û uma funûÏûÈo orgûÂnica caracterizada pelo grupo carbonila (>C=O) ligado aô doisô ûÀtomos de carbono. Diferencia-se do aldeûÙdo, onde a carbonila estûÀ ligada a pelo menos um hidrogûˆnio. A cetona mais conhecida ûˋ aô propanonaô (acetona), solvente de alto poder e componente de removedores de esmalte.
û fundamental diferenciar os dois grandes reinos da quûÙmica.ô FunûÏûçes InorgûÂnicasô (ûÀcidos, bases, sais e û°xidos) sûÈo tradicionalmente representadas por compostos de origem mineral, que podem ou nûÈo conter carbono (ex: COã, CaCOãô sûÈo inorgûÂnicos). Suas regras de nomenclatura e propriedades sûÈo distintas.
A principal diferenûÏa conceitual reside naô arquitetura molecular. As funûÏûçes orgûÂnicas sûÈo constituûÙdas pela formaûÏûÈo de cadeias de carbono. JûÀ as funûÏûçes inorgûÂnicas (inclui a vasta maioria dos compostos), embora possam conter o elemento carbono em sua composiûÏûÈo, nûÈo formam cadeias de ligaûÏûçes carbûÇnicas.
De se notar, portanto, que, enquanto os compostos inorgûÂnicos frequentemente formam estruturas iûÇnicas ou moleculares simples, os orgûÂnicos sûÈo baseados em cadeias ou anûˋis de carbono covalentes, o que lhes confere complexidade estrutural e diversidade muito maior.
Dessa forma, ao estudar funûÏûçes orgûÂnicas, o foco estûÀ nas ligaûÏûçes covalentes (compartilhamento de um ou mais pares de elûˋtrons para atingir a estabilidade) do carbono e na influûˆncia dos grupos funcionais nessas grandes molûˋculas.
Como costuma fazer com os demais temas, o Enem aborda QuûÙmica OrgûÂnica contextualizando-a com energia, meio ambiente, tecnologia e cotidiano. Logo, as questûçes nûÈo testam apenas a decoreba de nomes, mas aô capacidade de anûÀlise e interpretaûÏûÈo.

Exemplo de questûÈo (estilo Enem):
“O etanol, usado como combustûÙvel veicular, ûˋ obtido a partir da cana-de-aûÏû¤car por processo de fermentaûÏûÈo. Em uma etapa posterior, pode-se obter o eteno, matûˋria-prima para polûÙmeros como o polietileno. As funûÏûçes orgûÂnicas dos compostos citados sûÈo, respectivamente:
a) ûÀlcool e aldeûÙdo.
b) aldeûÙdo e cetona.
c)ô ûÀlcool e hidrocarboneto (alceno).
d) ûÀcido carboxûÙlico e ûÀlcool.
e) ûˋter e hidrocarboneto (alcano).”
ResoluûÏûÈo:ô O etanol (CHãCHãOH) possui grupo -OH, sendo umô ûÀlcool. O eteno (CHã=CHã) ûˋ um hidrocarboneto com dupla ligaûÏûÈo (alceno). A resposta correta ûˋ a letraô C.
Vestibulares como Fuvest, Unicamp e Unesp costumam ser mais densos no aspecto teû°rico e estrutural. Eles podem cobrarô isomeriaô (plana e espacial) entre compostos de diferentes funûÏûçes,ô reaûÏûçes orgûÂnicas especûÙficasô (como esterificaûÏûÈo ou saponificaûÏûÈo) eô identificaûÏûÈo de grupos funcionais em estruturas complexasô (como fûÀrmacos e biomolûˋculas).
Exemplo de QuestûÈo (Estilo Vestibular):
“O composto de fû°rmula CHãCOOCHãCHãCHã ûˋ um ûˋster que pode ser hidrolisado, produzindo:
a) um aldeûÙdo e um ûÀlcool.
b) uma cetona e um ûÀlcool.
c)ô um ûÀcido carboxûÙlico e um ûÀlcool.
d) um sal orgûÂnico e ûÀgua.
e) um ûˋter e uma base.”
ResoluûÏûÈo:ô a hidrû°lise de um ûˋster (R-COO-R’) sempre produz oô ûÀcido carboxûÙlicoô correspondente (R-COOH) e oô ûÀlcoolô correspondente (R’-OH). Portanto, a alternativa correta ûˋ aô C.
A teoria das funûÏûçes orgûÂnicas ûˋ encadeada e progressiva. Uma base mal consolidada compromete toda a aprendizagem subsequente.
û aqui que a metodologia doô Professor Ferrettoô se mostra uma das ferramentas mais eficazes para o estudante.
Baixe gratuitamente o Plano de Estudos Enem Anatomy!ô Ele vai ajudar vocûˆ a estruturar sua rotina e priorizar os temas mais importantes, comoô funûÏûçes orgûÂnicas. Acesse agora!
E para uma preparaûÏûÈo ainda mais profunda e direcionada, com videoaulas do Professor Ferretto cobrindo toda a teoria das funûÏûçes orgûÂnicas, exercûÙcios de fixaûÏûÈo e resolvidos, alûˋm de todo o conteû¤do programûÀtico de QuûÙmica e das outras disciplinas, explore o curso completo.
O curso aborda o tema de formaô lû°gica e gradativa, comeûÏando pela fundamentaûÏûÈo do ûÀtomo de carbono, passando pela classificaûÏûÈo de cadeias e, entûÈo, explorando cada funûÏûÈo orgûÂnica com profundidade.
Þô FaûÏa a melhor escolha! Prepare-se para o Enem com o Curso do Professor Ferretto!ô Domineô funûÏûçes orgûÂnicasô e todos os temas decisivos com a metodologia que jûÀ aprovou milhares de estudantes. Comece hoje mesmo, experimente o curso gratuito.
Dominar as funûÏûçes orgûÂnicas ûˋ, portanto, muito mais do que cumprir um tû°pico do edital. û adquirir a chave para entender a quûÙmica dos materiais, dos medicamentos, dos alimentos e da energia que movem o mundo moderno.
Como vimos, desde a simples identificaûÏûÈo do grupo funcional atûˋ a compreensûÈo de propriedades como solubilidade e reatividade ã que podem ser influenciadas por fatores como oô calor especûÙficoô do solvente ã, todo o conhecimento estûÀ interligado.
Para o Enem e vestibulares, esse domûÙnio se traduz em seguranûÏa para enfrentar questûçes que vûÈo desde a simples associaûÏûÈo atûˋ a anûÀlise de processos industriais ou ciclos biogeoquûÙmicos.
Utilize este guia como seu mapa de consulta, pratique incansavelmente a nomenclatura e a interpretaûÏûÈo de fû°rmulas, e associe sempre a teoria a exemplos concretos.
Dessa maneira, vocûˆ nûÈo estarûÀ apenas estudando para uma prova, mas construindo uma base sû°lida de conhecimento cientûÙfico que serûÀ û¤til muito alûˋm dos portûçes da universidade.

